Положение кремния в периодической системе химических элементов
Порядковый номер – 14, заряд ядра +14, протонов в ядре – 14, электронов – 14. Номер периода III – 14 электронов движутся по трём энергетическим уровням. Номер группы IV – на внешнем энергетическом уровне находятся 4 электрона. Радиус атома больше чем у углерода – увеличивается способность к отдаче электронов. Увеличиваются металлические и восстановительные свойства (в сравнении с углеродом). Si Ge Sn Pb. Общая характеристика кремния по положению в периодической системе. C.
Картинка 2 из презентации «Кремний» к урокам химии на тему «Кремний»Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать картинку для урока химии, щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как...». Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Кремний.ppt» целиком со всеми картинками в zip-архиве. Размер архива - 562 КБ.
Скачать презентациюКремний
«Урок Кремний» - Углекислый газ о себе и человечестве. Работа в парах, взаимопроверка – нет ошибок (5), две ошибки-(4), и т.д. 3% в воздухе – головокружение, шум в ушах, сонливость. 20% -смертельно для человека. О проявлении неметаллических и металлических свойств. Командная оценка. Что можно сказать о размере радиусов атомов от углерода до свинца?
«Кремний и его соединения» - Рассмотреть природные соединения кремния. Дать общую характеристику элементу кремний. Получение кремния. Кремний был впервые открыт в 1811 году Гей-Люссаком и Тенаром. Строение и свойства атомов. Оксид кремния в отличии от оксида углерода (IV) с водой не взаимодействует. Полупроводник. tплав(Si)=1415 ?C, tплав(алмаз)=3730 ?C.
«Изотопы кремния» - Получение поликристалличес-кого кремния. Зависимость положения максимума полосы комбинационного рассеяния от атомной массы. Горелка. Изготовление монокристаллической затравки. Зонноочищенный кремний. Защитное покрытие. Теплопроводность изотопнообогащенного кремния-28. Выращивание монокристаллов. Распределение концентрации изотопов по длине затравки.
«Соединения кремния» - Разновидности кварца. Яшма. Получение силикатов. Природные силикаты. Оксид кремния. Минералы на основе SiO2. Химические свойства SiO2. Открытие кремния. Кремний и его соединения. Кремний. Агат. Степень окисления. Электронная конфигурация. Силикаты и водород. Горный хрусталь. Нахождение в природе. Силан.
«Углерод и кремний» - Химические свойства. Одно из самых мягких среди твердых веществ. Силикатных кирпичи. Такая смесь называется генераторным газом. Рис.1 Модель решетки алмаза. Получающийся газ состоит из свободного азота и оксида углерода (II). Более 99% углерода в атмосфере содержится в виде углекислого газа. Положение в ПСХЭ.
«Кремний» - До завершения внешнего уровня кремнию не хватает 4 электронов. Оксид кремния (IV). Общая характеристика кремния по положению в периодической системе. В лабораториях кремний получают, восстанавливая оксид кремния SiO2. Физические свойства. Силикаты – соли кремниевой кислоты. Силикатная промышленность.
Всего в теме 6 презентаций
Здесь Вы можете скачать Урок по теме: "Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации" для предмета: Химия. Данный документ поможет вам подготовить хороший и качественный материал для урока.
Дата_____________ Класс_______________
Тема: Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации.
| Схема строения атома | Электронное строение последнего энергоуровня | Формула высшего оксида RO 2 | Формула летучего водородного соединения RH 4 | |
| 1. Углерод | C +6) 2 ) 4 | …2 s 2 2 p 2 | C +4 O 2 | C -4 H 4 |
| 2. Кремний | Si +14) 2 ) 8 ) 4 | …3 s 2 3 p 2 | Si +4 O 2 | Si -4 H 4 |
Как видно из схем строения атомов, на внешнем энергетическом уровне этих элементов находится 4 электрона, поэтому, углерод и кремний проявляют степень окисления +4 и -4.
Из схемы видно, что у тома углерода два неспаренных электрона на внешнем уровне (аналогично и у кремния). Этим объясняется, что углерод и кремний могут иметь степень окисления +2 (Например, СО – угарный газ). Переходя в возбуждённое состояние, один из s -электронов может перейти на свободную p -орбиталь. Тогда в атомах появляется 4 неспаренных электрона и степень окисления равна +4 и – 4.
2. Изменение свойств в подгруппе
В подгруппе углерода с ростом порядкового номера заряд ядра атомов увеличивается, число электронов на внешнем уровне постоянно, число энергетических уровней в атомах растёт и радиус атома увеличивается от углерода к свинцу, притяжение отрицательных электронов к положительному ядру ослабевает и способность к отдаче электронов увеличивается, и, следовательно, в подгруппе углерода с ростом порядкового номера неметаллические свойства убывают, а металлические усиливаются.
С и Si – неметаллы, Ge – полупроводник, Sn и Pb – металлы.
УГЛЕРОД. АЛЛОТРПОПИЯ УГЛЕРОДА
Углерод встречается в природе , как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см 3 ; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Применение:
Шлифовальный порошок, буры, стеклорезы, после огранки - бриллианты.
Графит
Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см 3 .
Применение:
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Карбин
Чёрный порошок; ρ = 2 г/см 3 ; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
При нагревании переходит в графит.
УрокКремний - важнейший элемент земной коры, по распространенности он занимает второе место после кислорода (примерно 27,6%).
Кремний имеет три изотопа: i (92,27%); (4,68%); (3,05%).
Кремний существует в двух аллотропных модификациях: аморфный и кристаллический . Различие в строении обусловливает и различие в физических свойствах этих модификаций. Аморфный кремний - бурый порошок, не имеет определенной температуры плавления. Кристаллический кремний по внешнему виду похож на металл, темно-серого цвета с металлическим блеском, тугоплавок (температура плавления 1400°С), но к металлам его не относят, так как он хрупок, слабо проводит электрический ток и проявляет химические свойства неметаллов.
Структура кристаллического кремния аналогична структуре алмаза. В его кристалле каждый атом соединен с четырьмя другими ковалентными связями. Причем ковалентная связь между атомами кремния значительно слабее, чем между атомами углерода в алмазе. Даже при обычных условиях часть связей разрушается и появляются свободные электроны, которые обусловливают небольшую электрическую проводимость. При нагревании и освещении число разрушающихся связей возрастает, следовательно, появляется больше свободных электронов, увеличивается электрическая проводимость.
Кристаллический кремний - полупроводник. Полупроводниками называют вещества, электрическая проводимость которых занимает промежуточное место между проводимостью металлов и диэлектриков. Более подробно вы будете изучать это явление на уроках физики в старших классах. На этом свойстве основано применение кремния при изготовлении выпрямителей переменного тока и солнечных батарей, преобразующих тепловую энергию солнца в электрическую. Такие батареи устанавливаются на искусственных спутниках Земли, используются и в наземных условиях.
Разное строение кремния (аморфного и кристаллического) обусловливает и разную химическую активность аллотропных модификаций. При обычных условиях кристаллический кремний инертен, а аморфный сгорает во фторе:

При нагревании кремний взаимодействует со многими неметаллами (кислородом, хлором, азотом, углеродом, серой), и при этом выделяется большое количество теплоты. Кремний соединяется с металлами. Эти соединения называются силицидами.
Задание. Задание 1. Напишите соответствующие уравнения реакций и укажите функции кремния в окислительно-восстановительных реакциях.
Задание 2. Напишите уравнения химических реакций кремния с магнием, алюминием. Укажите окислитель, восстановитель. Сделайте вывод, какую степень окисления проявляет кремний.
Кислоты (кроме плавиковой HF) на кремний не действуют, однако при сплавлении гидроксидов щелочных металлов с кремнием образуется соль кремниевой кислоты - силикат и водород:
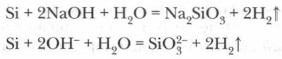
При высокой температуре кремний восстанавливает многие металлы из их оксидов:
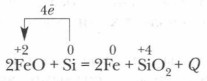
В чистом виде кремний в природе не встречается.
Впервые кремний был получен в 1822 г. шведским ученым И. Берцелиусом путем восстановления фторида кремния SiF 4 металлическим калием при нагревании до 400 °С. Еще легче его получить восстановлением SiO 2 металлическим магнием:
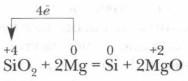
В промышленности кремний получают обычно при нагревании смеси песка и кокса:
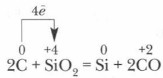
Восстановленный кремний частично реагирует с избытком углерода, и образуется карборунд Карборунд имеет алмазоподобную кристаллическую решетку, ковалентные связи в ней очень прочные, поэтому по твердости он близок к алмазу, используется для изготовления точильных камней и шлифовальных кругов.
Задание. Как правильно называть SiC - карбидом кремния или силицидом углерода? Дайте обоснованный ответ.
Соединения кремния
В природе кремний находится преимущественно в виде кремнезема (песка) SiO 2 и силикатов. Чистые кристаллы оксида кремния (IV) образуют несколько полиморфных модификаций, одна из которых кварц, встречающийся в виде горного хрусталя. Красиво окрашенные кристаллы кварца (аметист, дымчатый топаз, черный морион, сердолик, агат, опал, яшма и др.) являются полудрагоценными камнями.
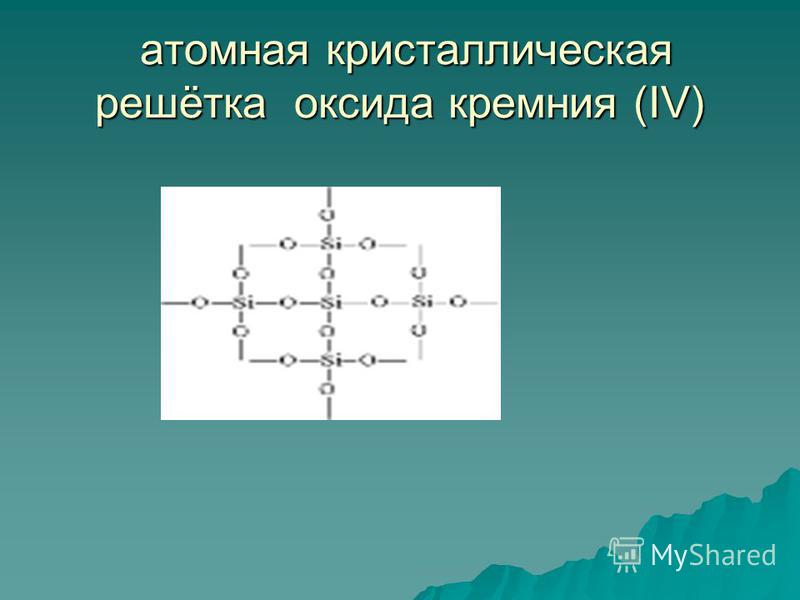
Оксид кремния (IV) SiO 2 - твердое тугоплавкое вещество (температура плавления 1713°С), нерастворимое в воде (рис. 54). Он обладает атомной кристаллической решеткой (рис. 55): здесь нет молекул, около каждого атома кремния располагаются четыре атома кислорода - образуется своеобразный пространственный каркас . Кусок кварца представляет собой как бы одну гигантскую молекулу. Кварц - неорганический полимер, его формула (SiO 2) n .
Характеристика по ПСХЭ 1. Положение в ПСХЭ. 1. Положение в ПСХЭ. 4 группа, главная подгруппа, 4 группа, главная подгруппа, 3 период.3 ряд 3 период.3 ряд Аr=28 Аr=28 степень окисления: степень окисления: -4, оксиды: оксиды: SiO (индифферентный) SiO (индифферентный) SiO 2 (кислотный) SiO 2 (кислотный) Кислота- кремневая Кислота- кремневая H 2 SiO 3 H 2 SiO 3
Z=+14 Z= р=14 +1 р=14 0 n=28-14=14 0 n=28-14=14 е=14 е=14 +14) 2) 8) 4 +14) 2) 8) S 2S 2P 3S 3P

Кремний является третьим (после кислорода и водорода) по Кремний является третьим (после кислорода и водорода) по распространенности элементом: на его долю приходиться распространенности элементом: на его долю приходиться 16,7 % от общего числа атомов земной коры. 16,7 % от общего числа атомов земной коры. В природе кремний встречается только в виде диоксидов и солей кремниевой кислоты (силикатов). Наиболее широко распространены алюмосиликаты. В природе кремний встречается только в виде диоксидов и солей кремниевой кислоты (силикатов). Наиболее широко распространены алюмосиликаты.

Основные минералы кремния Основные минералы кремния Al 2 O 3 *2SiO 2 *2H 2 O –Белая глина Al 2 O 3 *2SiO 2 *2H 2 O –Белая глина K 2 O*Al 2 O 3 *SiO 2 – полевой шпат K 2 O*Al 2 O 3 *SiO 2 – полевой шпат K 2 O*Al 2 O 3 *6SiO 2 *H 2 O – слюда K 2 O*Al 2 O 3 *6SiO 2 *H 2 O – слюда SiO 2 -кремнезем или речной песок SiO 2 -кремнезем или речной песок

Кремний- главный элемент в царстве минералов и горных пород. Чаще всего он встречается в виде минералов кварца (разновидности которого- кремень, кремнезём (песок), агат, яшма) и горного хрусталя, (разновидностями которого являются: аметист, дымчатый топаз). Кремний- главный элемент в царстве минералов и горных пород. Чаще всего он встречается в виде минералов кварца (разновидности которого- кремень, кремнезём (песок), агат, яшма) и горного хрусталя, (разновидностями которого являются: аметист, дымчатый топаз). В свободном виде кремний почти не встречается. В свободном виде кремний почти не встречается.

Некоторые морские организмы накапливают кремний в больших количествах. Некоторые морские организмы накапливают кремний в больших количествах. К богатым им морским растениям относят диатомовые водоросли, из животных- много кремния содержат радиолярии, кремниевые губки. К богатым им морским растениям относят диатомовые водоросли, из животных- много кремния содержат радиолярии, кремниевые губки.

А. в промышленности - восстановление углем в электрических печах а. в промышленности - восстановление углем в электрических печах SiO 2 +2С=Si+2CO SiO 2 +2С=Si+2CO б. в лаборатории - восстановление металлами кремнезема б. в лаборатории - восстановление металлами кремнезема 3SiO 2 +4Al=3Si+2Al 2 O 3 3SiO 2 +4Al=3Si+2Al 2 O 3

1)аморфный кремний – бурый порошок 1)аморфный кремний – бурый порошок t плавления 1420 С. t плавления 1420 С. 2)кристаллический кремний - твердое вещество, темно- серого цвета со слабым металлическим блеском, обладает тепло и электропроводностью 2)кристаллический кремний - твердое вещество, темно- серого цвета со слабым металлическим блеском, обладает тепло и электропроводностью

А)взаимодействие с простыми веществами. а)взаимодействие с простыми веществами. Si-восстановитель Si-восстановитель 1) с галогенами 1) с галогенами Si+2F 2 =SF 4 - фторид кремния Si+2F 2 =SF 4 - фторид кремния 2) с кислородом 2) с кислородом Si+O 2 SiO 2 -оксид кремния (lV) Si+O 2 SiO 2 -оксид кремния (lV) 3) с азотом 3) с азотом 3Si +2N 2 =Si 3 N 4 -нитрид кремния 3Si +2N 2 =Si 3 N 4 -нитрид кремния 4)с углеродом 4)с углеродом Si + C= SiC -карбид кремния или Si + C= SiC -карбид кремния или карборунд карборунд

Si-окислитель Si-окислитель 5)с металлами 5)с металлами Si+ 2Mg=t Mg 2 Si -силицид магния Si+ 2Mg=t Mg 2 Si -силицид магния Непосредственно с водородом кремний не реагирует. Непосредственно с водородом кремний не реагирует. SiH 4 получают косвенным путем. SiH 4 получают косвенным путем. Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (силан, ядовитый газ) (силан, ядовитый газ)

Б)взаимодействие со сложными веществами 1) из галогеноводородов реакция идет только с HF 1) из галогеноводородов реакция идет только с HF Si+4HF=SiF 4 +2H 2 Si+4HF=SiF 4 +2H 2 2)из кислот реакция идет только со смесью азотной и плавиковой 2)из кислот реакция идет только со смесью азотной и плавиковой 3Si+12HF+4HNO 3 =3SiF 4 +4NO +8H 2 O 3Si+12HF+4HNO 3 =3SiF 4 +4NO +8H 2 O При действии других кислот на поверхности кремния образуется плотная оксидная пленка SiO 2 При действии других кислот на поверхности кремния образуется плотная оксидная пленка SiO 2 3) взаимодействие со щелочами 3) взаимодействие со щелочами Si+2NaOH+H 2 O=Na 2 SiO 3 +2H 2 Si+2NaOH+H 2 O=Na 2 SiO 3 +2H 2

Открытие. В 1834 году русский химик Гесс дал этому элементу русское название. В 1834 году русский химик Гесс дал этому элементу русское название. Кремний был Кремний был открыт в 1825 году открыт в 1825 году шведским химиком шведским химиком Берцелиусом. Берцелиусом.

Применение Применяется в технике для получения полупроводниковых материалов и сплавов. Так же для получения стекла и цемента, резцов для метало - режущих станков. Применяется в технике для получения полупроводниковых материалов и сплавов. Так же для получения стекла и цемента, резцов для метало - режущих станков.

Оксид кремния (IV) или кремнезём Оксид кремния (IV) или кремнезём 1. Строение: Оксид кремния (IV) имеет не молекулярную (как у углекислого газа), а атомную кристаллическую решётку 1. Строение: Оксид кремния (IV) имеет не молекулярную (как у углекислого газа), а атомную кристаллическую решётку Поэтому SiO 2 твёрдое и тугоплавкое вещество, Поэтому SiO 2 твёрдое и тугоплавкое вещество, Которое не растворяется в воде и кислотах, кроме плавиковой (вспомни галогеноводородные кислоты). Которое не растворяется в воде и кислотах, кроме плавиковой (вспомни галогеноводородные кислоты).