A szilícium helyzete a kémiai elemek periódusos rendszerében
Sorozatszám - 14, nukleáris töltés +14, protonok az atommagban - 14, elektronok - 14. III. periódusszám - 14 elektron három energiaszint mentén mozog. IV. számú csoport - a külső energiaszinten 4 elektron található. Az atom sugara nagyobb, mint a széné - az elektronok visszajuttatásának képessége nő. Fokozott fémes és redukáló tulajdonságok (a szénhez képest). Si Ge Sn Pb. Általános jellemzők szilícium a periódusos rendszerben elfoglalt pozíció szerint. C.
2. kép a "Szilícium" bemutatóról kémiaórákra a "Szilícium" témábanMéretek: 960 x 720 pixel, formátum: jpg. Ha ingyenesen szeretne letölteni egy képet egy kémiaórához, kattintson a jobb gombbal a képre, majd kattintson a "Kép mentése másként..." gombra. A leckében való képek megjelenítéséhez ingyenesen letöltheti a "Silicon.ppt" teljes prezentációt az összes képpel egy zip archívumban. Archívum mérete - 562 KB.
Prezentáció letöltéseSzilícium
"Szilícium lecke" - Szén-dioxid önmagáról és az emberiségről. Páros munka, kölcsönös ellenőrzés - nincs hiba (5), két hiba (4) stb. 3% a levegőben - szédülés, fülzúgás, álmosság. 20%-a halálos az emberre. A nemfémes és fémes tulajdonságok megnyilvánulásáról. Csapat értékelés. Mit mondhatunk a széntől az ólomig terjedő atomi sugarak méretére?
"Szilícium és vegyületei" - Vegye figyelembe a szilícium természetes vegyületeit. Ismertesse a szilícium elemet! Szilícium beszerzése. A szilíciumot először 1811-ben Gay-Lussac és Tenard fedezte fel. Az atomok szerkezete és tulajdonságai. A szilícium-oxid a szén-monoxiddal (IV) ellentétben nem lép kölcsönhatásba vízzel. Félvezető. olvadék(Si)=1415 °C, olvadék (gyémánt)=3730 °C.
"Szilícium izotópjai" - Polikristályos szilícium előállítása. A Raman-sáv maximumának helyzetének függősége az atomtömegtől. Égő. Egykristályos vetőmag előállítása. Zónában tisztított szilícium. Védőburkolat. Izotóposan dúsított szilícium-28 hővezető képessége. Növekvő egykristályok. Az izotópkoncentráció eloszlása a mag hossza mentén.
"Szilíciumvegyületek" - A kvarc fajtái. Jáspis. Szilikátok beszerzése. természetes szilikátok. szilícium-oxid. SiO2 alapú ásványok. A SiO2 kémiai tulajdonságai. A szilícium felfedezése. Szilícium és vegyületei. Szilícium. Achát. Az oxidáció mértéke. Elektronikus konfiguráció. szilikátok és hidrogén. Hegyikristály. Megtalálás a természetben. Szilán.
"Szén és szilícium" - Kémiai tulajdonságok. Az egyik legpuhább a szilárd anyagok között. szilikát tégla. Ezt a keveréket termelőgáznak nevezik. 1. ábra Gyémánt rácsos modell. A keletkező gáz szabad nitrogénből és szén-monoxidból (II) áll. A légkörben lévő szén több mint 99%-a szén-dioxid formájában van. Pozíció a PSHE-ben.
"Szilícium" - A külső szint befejezése előtt a szilíciumból 4 elektron hiányzik. Szilícium (IV) oxid. A szilícium általános jellemzői a periódusos rendszerben elfoglalt helyzet szerint. A laboratóriumokban a szilíciumot szilícium-oxid SiO2 redukálásával nyerik. fizikai tulajdonságok. A szilikátok a kovasav sói. szilikát ipar.
A témában összesen 6 előadás található
Innen letöltheti a következő témát: "A szén és a szilícium helyzete a periódusos rendszerben kémiai elemek, atomjaik szerkezete. Carbon, allotropic modifikations" tárgyhoz: Kémia. Ez a dokumentum segít egy jó és minőségi tananyag elkészítésében az órán.
Dátum _____________ Osztály _______________
Tantárgy: A szén és a szilícium helyzete a kémiai elemek periodikus rendszerében, atomjaik szerkezete. Szén, allotróp módosítások.
| Az atom szerkezetének diagramja | Az utolsó energiaszint elektronikus szerkezete | Kiváló oxid formulaRO 2 | Illékony hidrogénvegyület képlete RH 4 | |
| 1. Szén | C+6) 2 ) 4 | …2 s 2 2 p 2 | C +4 O 2 | C -4 H 4 |
| 2. Szilícium | Si +14) 2 ) 8 ) 4 | …3 s 2 3 p 2 | Si +4 O 2 | Si -4 H 4 |
Az atomok szerkezeti diagramjaiból látható, hogy ezen elemek külső energiaszintjében 4 elektron található, ezért a szén és a szilícium +4 és -4 oxidációs állapotot mutat.
A diagramból látható, hogy a széntérfogatban két párosítatlan elektron van a külső szinten (hasonlóan a szilícium). Ez megmagyarázza, hogy a szén és a szilícium oxidációs állapota +2 lehet (például a CO szén-monoxid). Gerjesztett állapotba kerülve az egyik s-elektron szabad p-pályára kerülhet. Ekkor 4 párosítatlan elektron jelenik meg az atomokban és az oxidációs állapot +4 és -4.
2. Tulajdonságok módosítása egy alcsoportban
A szén alcsoportban a sorszám növekedésével az atommag töltése növekszik, a külső szinten az elektronok száma állandó, az atomokban az energiaszintek száma nő és az atom sugara szénről ólomra nő, gyengül a negatív elektronok vonzása a pozitív atommaghoz, és nő az elektronadó képesség, ennek következtében a szén alcsoportban a sorozatszám növekedésével csökkennek a nemfémes tulajdonságok, és nőnek a fémes tulajdonságok.
C és Si nemfémek, Ge félvezető, Sn és Pb fémek.
SZÉN. A SZÉN ALLOTRPÓPIÁJA
A szén megtalálható a természetben, mind szabad formában, mind vegyületek formájában. Szabad formában fordul elő, mint allotróp módosítások– gyémánt, grafit, karabély, fullerén.
gyémánt
Kristályos anyag, átlátszó, erősen megtöri a fénysugarakat, nagyon szilárd, nem vezet elektromos áramot, rosszul vezeti a hőt, ρ = 3,5 g/cm3; t°pl. = 3730 °C; t°forr = 4830 °C.
Grafitból nyerhető p > 50 ezer atm; t° = 1200°C.
Alkalmazás:
Csiszolópor, fúrók, üvegvágók, vágás után - gyémántok.
Grafit
Kristályos anyag, réteges, átlátszatlan, sötétszürke, fémes fényű, puha, elektromos áramot vezet; ρ \u003d 2,5 g / cm 3.
Alkalmazás:
Elektródák, ceruzavezetékek, neutronmoderátorok az atomreaktorokban, egyes kenőanyagok részét képezik.
Karabély
Fekete por; ρ \u003d 2 g / cm 3; félvezető.
Lineáris láncokból áll –C≡C–C≡C– és =C=C=C=C=.
Melegítéskor grafittá alakul.
LeckeA szilícium a földkéreg legfontosabb eleme, elterjedtségét tekintve az oxigén után a második helyen áll (kb. 27,6%).
A szilíciumnak három izotópja van: i (92,27%); (4,68%); (3,05%).
A szilícium két allotróp változatban létezik: amorfÉs kristály. A szerkezeti különbség meghatározza a különbséget is fizikai tulajdonságok ezeket a módosításokat. Amorf szilícium- barna por, nincs határozott olvadáspontja. Kristályos szilícium által kinézet fémhez hasonló, sötétszürke, fémes fényű, tűzálló (olvadáspont 1400 °C), de nem minősül fémnek, mivel törékeny, gyengén vezeti az elektromos áramot és jól mutat Kémiai tulajdonságok nemfémek.
Szerkezet kristályos szilícium hasonló a gyémánt szerkezetéhez. Kristályában minden atom négy másik kovalens kötéssel kapcsolódik össze. Ráadásul a szilícium atomok közötti kovalens kötés sokkal gyengébb, mint a gyémánt szénatomjai között. Normál körülmények között is a kötések egy része megsemmisül, szabad elektronok jelennek meg, amelyek kis elektromos vezetőképességet okoznak. Fűtéssel és megvilágítással megnő a megszakadt kötések száma, ezért több szabad elektron jelenik meg, és nő az elektromos vezetőképesség.
A kristályos szilícium egy félvezető. A félvezetők olyan anyagok, amelyek elektromos vezetőképessége közbenső a fémek és a dielektrikumok vezetőképessége között. Ezt a jelenséget a középiskolai fizikaórákon fogod részletesebben tanulmányozni. Ez a tulajdonság az alapja a szilícium felhasználásának a váltóáramú egyenirányítók és a nap hőenergiáját elektromos energiává alakító napelemek gyártásakor. Az ilyen akkumulátorokat mesterséges földi műholdakra telepítik, és a földön is használják.
A szilícium eltérő szerkezete (amorf és kristályos) az allotróp módosulatok eltérő kémiai aktivitását is meghatározza. Normál körülmények között a kristályos szilícium inert, míg az amorf szilícium fluorban ég:

Hevítéskor a szilícium kölcsönhatásba lép számos nemfémmel (oxigén, klór, nitrogén, szén, kén), és felszabadul. nagyszámú melegség. A szilícium egyesül a fémekkel. Ezeket a vegyületeket szilicideknek nevezzük.
Gyakorlat. Feladat 1. Írja fel a megfelelő reakcióegyenleteket, és jelölje meg a szilícium funkcióit a redox reakciókban!
2. feladat.Írja fel a szilícium kémiai reakcióinak egyenleteit magnéziummal, alumíniummal! Adja meg az oxidálószert, redukálószert. Tudja meg, milyen oxidációs állapotú a szilícium.
A savak (a hidrogén-fluoridos HF kivételével) nem hatnak a szilíciumon, azonban az alkálifém-hidroxidok szilíciummal való olvasztásakor a kovasav sója képződik - szilikát és hidrogén:
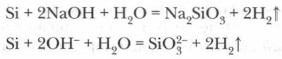
Nál nél magas hőmérsékletű A szilícium számos fémet visszaállít oxidjaiból:
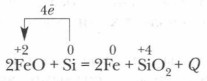
A szilícium tiszta formában nem található meg a természetben.
A szilíciumot először 1822-ben I. Berzelius svéd tudós kapott szilícium-fluorid SiF 4 redukálásával fémkáliummal 400 °C-ra melegítve. Még egyszerűbb a SiO 2 fémes magnéziummal történő redukálásával előállítani:
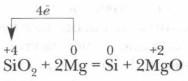
Az iparban a szilíciumot általában homok és koksz keverékének hevítésével nyerik:
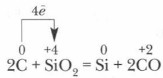
A redukált szilícium részlegesen reagál a feleslegben lévő szénnel, és képződik karborundum A karborundumnak gyémántszerű kristályrácsa van, a benne lévő kovalens kötések nagyon erősek, ezért keménysége közel áll a gyémánthoz, köszörűkövek, köszörűkorongok készítésére használják.
Gyakorlat. Mi a helyes neve a SiC - szilícium-karbidnak vagy szén-szilicidnek? Adjon indokolt választ.
Szilíciumvegyületek
A természetben a szilícium főként szilícium-dioxid (homok) SiO 2 és szilikátok formájában található. A szilícium-oxid (IV) tiszta kristályai több polimorf módosulatot képeznek, amelyek közül az egyik a kvarc, amely hegyikristály formájában fordul elő. A gyönyörű színű kvarckristályok (ametiszt, füstös topáz, fekete morion, karneol, achát, opál, jáspis stb.) féldrágakövek.
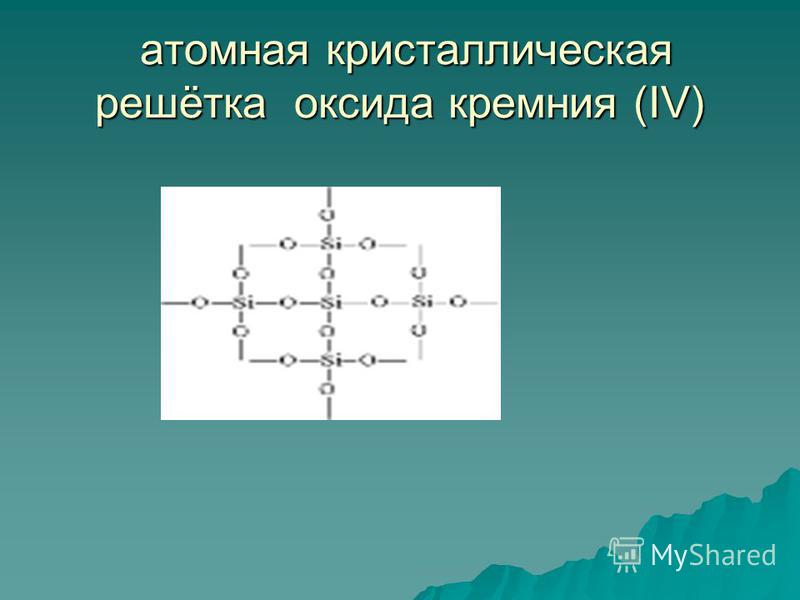
Szilícium(IV)-oxid A SiO 2 szilárd tűzálló anyag (olvadáspont 1713 °C), vízben oldhatatlan (54. ábra). Ő birtokol atom kristályrács (55. ábra): itt nincsenek molekulák, minden szilíciumatom közelében négy oxigénatom található - egyfajta térbeli keret. Egy darab kvarc olyan, mint egy óriási molekula. A kvarc egy szervetlen polimer, képlete (SiO 2) n.
A PSCE jellemzői 1. Pozíció a PSCE-ben. 1. Pozíció a PSCE-ben. 4 csoport, fő alcsoport, 4 csoport, fő alcsoport, 3 periódus 3 sor 3 periódus 3 sor Ar=28 Ar=28 oxidációs állapot: oxidációs állapot: -4, oxidok: oxidok: SiO (közömbös) SiO (közömbös) SiO 2 (savas) SiO 2 (savas) Kovasav Kovasav H 2 SiO 3 H 2 SiO 3
Z=+14 Z= p=14 +1 p=14 0 n=28-14=14 0 n=28-14=14 e=14 e=14 +14) 2) 8) 4 +14) 2) 8 ) S 2S 2P 3S 3P

A szilícium a harmadik (az oxigén és a hidrogén után) a szilíciumban a harmadik (az oxigén és a hidrogén után) a legnagyobb mennyiségben előforduló elem: ez adja az elem bőségét: a földkéreg összes atomszámának 16,7%-át teszi ki. A földkéregben található atomok teljes számának 16,7%-a. A természetben a szilícium csak dioxidok és kovasavsók (szilikátok) formájában fordul elő. Az alumínium-szilikátok a legelterjedtebbek. A természetben a szilícium csak dioxidok és kovasavsók (szilikátok) formájában fordul elő. Az alumínium-szilikátok a legelterjedtebbek.

Alap szilíciumos ásványok Alap szilícium ásványok Al 2 O 3 *2SiO 2 *2H 2 O – Fehér agyag Al 2 O 3 * 2SiO 2 * 2H 2 O - fehér agyag K 2 O * Al 2 O 3 * SiO 2 - földpát K 2 O * Al 2 O 3 * SiO 2 - földpát K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - csillám K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - csillám SiO 2 - szilícium-dioxid vagy folyami homok SiO 2 - szilícium-dioxid vagy folyami homok

A szilícium az ásványok és kőzetek birodalmának fő eleme. Leggyakrabban kvarc ásványok formájában található meg (melynek fajtái a kovakő, szilícium-dioxid (homok), achát, jáspis) és hegyikristály (amelynek fajtái: ametiszt, füstös topáz). A szilícium az ásványok és kőzetek birodalmának fő eleme. Leggyakrabban kvarc ásványok formájában található meg (melynek fajtái a kovakő, szilícium-dioxid (homok), achát, jáspis) és hegyikristály (amelynek fajtái: ametiszt, füstös topáz). A szilícium szinte soha nem található szabad formában. A szilícium szinte soha nem található szabad formában.

Egyes tengeri élőlények nagy mennyiségben halmozzák fel a szilíciumot. Egyes tengeri élőlények nagy mennyiségben halmozzák fel a szilíciumot. A bennük gazdag tengeri növények közé tartoznak a kovamoszatok, az állatokból pedig a radioláriumok és a szilíciumszivacsok sok szilíciumot tartalmaznak. A bennük gazdag tengeri növények közé tartoznak a kovamoszatok, az állatokból pedig a radioláriumok és a szilíciumszivacsok sok szilíciumot tartalmaznak.

A. az iparban - kinyerés szénnel elektromos kemencékben a. iparban - szénnel való redukció elektromos kemencékben SiO 2 +2C=Si+2CO SiO 2 +2C=Si+2CO b. laboratóriumban - szilícium-dioxid fémredukciója b. laboratóriumban - szilícium-dioxid fémek redukciója 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3

1) amorf szilícium - barna por 1) amorf szilícium - barna por, olvadáspont t 1420 C. olvadáspont t 1420 C. 2) kristályos szilícium - szilárd, sötétszürke színű, enyhe fémes fényű, hő- és elektromos vezetőképességű 2) kristályos szilícium - szilárd, sötétszürke, enyhe fémes fényű, hő- és elektromos vezetőképességgel rendelkezik

A) interakció vele egyszerű anyagok. a) kölcsönhatás egyszerű anyagokkal. Si redukálószer Si redukálószer 1) halogénekkel 1) halogénekkel Si+2F 2 =SF 4 - szilícium-fluorid Si+2F 2 =SF 4 - szilícium-fluorid 2) oxigénnel 2) oxigénnel Si+O 2 SiO 2 oxid szilícium (lV) Si + O 2 SiO 2 - szilícium-oxid (lV) 3) nitrogénnel 3) nitrogénnel 3Si + 2N 2 = Si 3 N 4 - szilícium-nitrid 3Si + 2N 2 = Si 3 N 4 - szilícium-nitrid 4) szén 4) szénnel Si + C= SiC - szilícium-karbid vagy Si + C= SiC - szilícium-karbid vagy karborund karborund

Si-oxidálószer Si-oxidálószer 5) fémekkel 5) fémekkel Si + 2Mg \u003d t Mg 2 Si - magnézium-szilicid Si + 2Mg \u003d t Mg 2 Si - magnézium-szilicid A szilícium nem reagál közvetlenül a hidrogénnel. A szilícium nem reagál közvetlenül a hidrogénnel. A SiH 4-et közvetetten nyerik. A SiH 4-et közvetetten nyerik. Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (szilán, mérges gáz) (szilán, mérges gáz)

B) kölcsönhatás összetett anyagokkal 1) hidrogén-halogenidekből, a reakció csak HF-vel megy végbe 1) hidrogén-halogenidekből, a reakció csak HF-vel megy végbe Si + 4HF = SiF 4 + 2H 2 Si + 4HF = SiF 4 + 2H 2 2) savakból a reakció csak salétromsav és fluorhidrogén keverékével megy végbe 2) savakból, a reakció csak salétrom- és fluorhidrogén 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + keverékével megy végbe. 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O Más savak hatására a szilícium felületén sűrű SiO 2 oxidfilm képződik Más savak hatására a szilícium felületén sűrű SiO 2 oxidfilm képződik. szilícium felülete 3) kölcsönhatás lúgokkal 3) kölcsönhatás lúgokkal + H 2 O \u003d Na 2 SiO 3 + 2H 2

Nyítás. 1834-ben Hess orosz vegyész adta ennek az elemnek az orosz nevet. 1834-ben Hess orosz vegyész adta ennek az elemnek az orosz nevet. Felfedezték a szilíciumot A szilíciumot 1825-ben fedezte fel Berzelius svéd vegyész 1825-ben. Berzelius.

Alkalmazás Félvezető anyagok és ötvözetek gyártására szolgáló mérnöki tudományokban. Üveg és cement gyártásához, fémvágó gépekhez való marókhoz is. A gépészetben használják félvezető anyagok és ötvözetek előállítására. Üveg és cement gyártásához, fémvágó gépekhez való marókhoz is.

Szilícium (IV) oxid vagy szilícium-dioxid Szilícium (IV) oxid vagy szilícium-dioxid 1. Szerkezete: A szilícium (IV) oxidnak nem molekuláris (mint a szén-dioxidnak), hanem atomos kristályrácsa van. -molekuláris (mint a szén-dioxid), de az atomos kristályrács Ezért a SiO 2 szilárd és tűzálló anyag, Ezért a SiO 2 szilárd és tűzálló anyag, amely nem oldódik vízben és savakban, kivéve a hidrogén-fluoridot (emlékezzünk a hidrogén-halogenidekre ). Ami vízben és savakban oldhatatlan, kivéve a hidrogén-fluoridot (emlékezzünk a hidrogén-halogenidekre).