रासायनिक तत्वों की आवर्त सारणी में सिलिकॉन की स्थिति
क्रम संख्या - 14, परमाणु आवेश +14, नाभिक में प्रोटॉन - 14, इलेक्ट्रॉन - 14। अवधि संख्या III - 14 इलेक्ट्रॉन तीन ऊर्जा स्तरों के साथ चलते हैं। समूह संख्या IV - बाहरी ऊर्जा स्तर में 4 इलेक्ट्रॉन होते हैं। परमाणु की त्रिज्या कार्बन से अधिक होती है - इलेक्ट्रॉनों को वापस करने की क्षमता बढ़ जाती है। धात्विक और कम करने वाले गुणों में वृद्धि (कार्बन की तुलना में)। सी जीई एसएन पीबी। सामान्य विशेषताएँआवर्त प्रणाली में स्थिति के अनुसार सिलिकॉन। सी।
चित्र 2 प्रस्तुति "सिलिकॉन" से"सिलिकॉन" विषय पर रसायन विज्ञान के पाठआयाम: 960 x 720 पिक्सेल, प्रारूप: jpg। रसायन विज्ञान के पाठ के लिए चित्र को मुफ्त में डाउनलोड करने के लिए, छवि पर राइट-क्लिक करें और "इस रूप में छवि सहेजें ..." पर क्लिक करें। पाठ में चित्र दिखाने के लिए, आप एक ज़िप संग्रह में सभी चित्रों के साथ पूरी प्रस्तुति "सिलिकॉन.पीपीटी" को मुफ्त में डाउनलोड कर सकते हैं। पुरालेख का आकार - 562 केबी।
प्रस्तुति डाउनलोड करेंसिलिकॉन
"सिलिकॉन लेसन" - अपने और मानवता के बारे में कार्बन डाइऑक्साइड। जोड़ियों में काम करें, आपसी जाँच - कोई त्रुटि नहीं (5), दो त्रुटियाँ- (4), आदि। हवा में 3% - चक्कर आना, टिनिटस, उनींदापन। 20% मनुष्य के लिए घातक है। अधात्विक और धात्विक गुणों के प्रकट होने पर। टीम रेटिंग। कार्बन से लेड तक परमाणु त्रिज्या के आकार के बारे में क्या कहा जा सकता है?
"सिलिकॉन और इसके यौगिक" - सिलिकॉन के प्राकृतिक यौगिकों पर विचार करें। सिलिकॉन तत्व का वर्णन कीजिए। सिलिकॉन प्राप्त करना। सिलिकॉन की खोज सबसे पहले 1811 में Gay-Lussac और Tenard ने की थी। परमाणुओं की संरचना और गुण। सिलिकॉन ऑक्साइड, कार्बन मोनोऑक्साइड (IV) के विपरीत, पानी के साथ परस्पर क्रिया नहीं करता है। सेमीकंडक्टर। tmelt(Si)=1415 ?C, tmelt(हीरा)=3730 ?C.
"सिलिकॉन के समस्थानिक" - पॉलीक्रिस्टलाइन सिलिकॉन प्राप्त करना। रमन बैंड अधिकतम की परमाणु द्रव्यमान पर निर्भरता। बर्नर। एकल-क्रिस्टल बीज का उत्पादन। ज़ोन-शुद्ध सिलिकॉन। सुरक्षात्मक आवरण। समस्थानिक रूप से समृद्ध सिलिकॉन-28 की तापीय चालकता। बढ़ते एकल क्रिस्टल। बीज की लंबाई के साथ आइसोटोप एकाग्रता का वितरण।
"सिलिकॉन यौगिक" - क्वार्ट्ज की किस्में। जैस्पर। सिलिकेट प्राप्त करना। प्राकृतिक सिलिकेट। सिलिकॉन ऑक्साइड। SiO2 पर आधारित खनिज। SiO2 के रासायनिक गुण। सिलिकॉन की खोज। सिलिकॉन और उसके यौगिक। सिलिकॉन। सुलेमानी। ऑक्सीकरण की डिग्री। इलेक्ट्रोनिक विन्यास। सिलिकेट और हाइड्रोजन। स्फटिक। प्रकृति में ढूँढना। सिलेन।
"कार्बन और सिलिकॉन" - रासायनिक गुण। ठोस पदार्थों में सबसे नरम में से एक। सिलिकेट ईंटें। इस मिश्रण को प्रोड्यूसर गैस कहते हैं। Fig.1 हीरा जाली मॉडल। परिणामी गैस में मुक्त नाइट्रोजन और कार्बन मोनोऑक्साइड (II) होते हैं। वायुमंडल में 99% से अधिक कार्बन कार्बन डाइऑक्साइड के रूप में है। पीएसएचई में स्थिति।
"सिलिकॉन" - बाहरी स्तर के पूरा होने से पहले, सिलिकॉन में 4 इलेक्ट्रॉनों की कमी होती है। सिलिकॉन (चतुर्थ) ऑक्साइड। आवधिक प्रणाली में स्थिति द्वारा सिलिकॉन की सामान्य विशेषताएं। प्रयोगशालाओं में, सिलिकॉन ऑक्साइड SiO2 को कम करके सिलिकॉन प्राप्त किया जाता है। भौतिक गुण। सिलिकेट्स सिलिकिक एसिड के लवण हैं। सिलिकेट उद्योग।
विषय में कुल 6 प्रस्तुतियाँ हैं
यहाँ आप इस विषय पर पाठ डाउनलोड कर सकते हैं: "आवर्त प्रणाली में कार्बन और सिलिकॉन की स्थिति रासायनिक तत्व, उनके परमाणुओं की संरचना। कार्बन, एलोट्रोपिक संशोधन" विषय के लिए: रसायन विज्ञान। यह दस्तावेज़ आपको पाठ के लिए एक अच्छी और उच्च गुणवत्ता वाली सामग्री तैयार करने में मदद करेगा।
दिनांक _____________ कक्षा _______________
विषय:रासायनिक तत्वों की आवधिक प्रणाली में कार्बन और सिलिकॉन की स्थिति, उनके परमाणुओं की संरचना। कार्बन, एलोट्रोपिक संशोधन।
| परमाणु की संरचना का आरेख | अंतिम ऊर्जा स्तर की इलेक्ट्रॉनिक संरचना | सुपीरियर ऑक्साइड फॉर्मूलाआरओ 2 | वाष्पशील हाइड्रोजन यौगिक सूत्र आरएच 4 | |
| 1. कार्बन | सी+6) 2 ) 4 | …2 एस 2 2 पी 2 | सी +4 हे 2 | सी -4 एच 4 |
| 2. सिलिकॉन | सी +14) 2 ) 8 ) 4 | …3 एस 2 3 पी 2 | सी +4 हे 2 | सी -4 एच 4 |
जैसा कि परमाणुओं की संरचना के आरेखों से देखा जा सकता है, इन तत्वों के बाह्य ऊर्जा स्तर में 4 इलेक्ट्रॉन होते हैं, इसलिए, कार्बन और सिलिकॉन +4 और -4 के ऑक्सीकरण अवस्था को प्रदर्शित करते हैं।
आरेख से यह देखा जा सकता है कि कार्बन आयतन में बाहरी स्तर पर दो अयुग्मित इलेक्ट्रॉन हैं (इसी प्रकार, सिलिकॉन)। यह बताता है कि कार्बन और सिलिकॉन में +2 की ऑक्सीकरण अवस्था हो सकती है (उदाहरण के लिए, CO कार्बन मोनोऑक्साइड है)। उत्तेजित अवस्था में जाने पर, एस-इलेक्ट्रॉनों में से एक मुक्त पी-ऑर्बिटल में जा सकता है। तब परमाणुओं में 4 अयुग्मित इलेक्ट्रॉन दिखाई देते हैं और ऑक्सीकरण अवस्था +4 और -4 होती है।
2. एक उपसमूह में गुण बदलें
कार्बन उपसमूह में क्रम संख्या बढ़ने से परमाणुओं के नाभिक का आवेश बढ़ जाता है, बाहरी स्तर पर इलेक्ट्रॉनों की संख्या स्थिर होती है, परमाणुओं में ऊर्जा के स्तर की संख्या बढ़ जाती है और परमाणु की त्रिज्या कार्बन से सीसा तक बढ़ जाती है, सकारात्मक नाभिक के लिए नकारात्मक इलेक्ट्रॉनों का आकर्षण कमजोर हो जाता है और इलेक्ट्रॉनों को दान करने की क्षमता बढ़ जाती है, और इसके परिणामस्वरूप, कार्बन उपसमूह में, सीरियल नंबर बढ़ने के साथ, गैर-धातु गुण कम हो जाते हैं, और धातु गुण बढ़ जाते हैं।
C और Si अधातु हैं, Ge एक अर्धचालक है, Sn और Pb धातु हैं।
कार्बन। कार्बन का आवंटन
कार्बन प्रकृति में पाया जाता है, दोनों मुक्त रूप में और यौगिकों में। यह मुक्त रूप में होता है एलोट्रोपिक संशोधन- हीरा, ग्रेफाइट, कार्बाइन, फुलरीन।
हीरा
क्रिस्टलीय पदार्थ, पारदर्शी, प्रकाश किरणों को दृढ़ता से अपवर्तित करता है, बहुत ठोस, विद्युत प्रवाह का संचालन नहीं करता है, गर्मी का खराब संचालन करता है, ρ = 3.5 g/cm3; टी ° पीएल। = 3730 डिग्री सेल्सियस; टी ° उबलते = 4830 डिग्री सेल्सियस।
ग्रेफाइट से पी> 50 हजार एटीएम पर प्राप्त किया जा सकता है; टी ° = 1200 डिग्री सेल्सियस।
आवेदन पत्र:
पीस पाउडर, ड्रिल, ग्लास कटर, काटने के बाद - हीरे।
सीसा
क्रिस्टलीय पदार्थ, स्तरित, अपारदर्शी, गहरा भूरा, धातु की चमक, मुलायम, विद्युत प्रवाह का संचालन करता है; ρ \u003d 2.5 ग्राम / सेमी 3।
आवेदन पत्र:
परमाणु रिएक्टरों में इलेक्ट्रोड, पेंसिल लीड, न्यूट्रॉन मॉडरेटर, कुछ स्नेहक का हिस्सा हैं।
काबैन
काला पाउडर; ρ \u003d 2 ग्राम / सेमी 3; अर्धचालक।
रैखिक श्रृंखलाओं से मिलकर बनता है –C≡C–C≡C– और =C=C=C=C=.
गर्म करने पर यह ग्रेफाइट में बदल जाता है।
पाठसिलिकॉन पृथ्वी की पपड़ी का सबसे महत्वपूर्ण तत्व है, प्रसार के संदर्भ में, यह ऑक्सीजन (लगभग 27.6%) के बाद दूसरे स्थान पर है।
सिलिकॉन के तीन समस्थानिक हैं: i (92.27%); (4.68%); (3.05%)।
सिलिकॉन दो अलॉट्रोपिक संशोधनों में मौजूद है: बेढबतथा क्रिस्टल. संरचना में अंतर भी अंतर को निर्धारित करता है भौतिक गुणये संशोधन। अनाकार सिलिकॉन- ब्राउन पाउडर, कोई निश्चित गलनांक नहीं है। क्रिस्टलीय सिलिकॉन द्वारा दिखावटधातु के समान, एक धात्विक चमक के साथ गहरे भूरे रंग का, दुर्दम्य (गलनांक 1400 ° C), लेकिन इसे धातु के रूप में वर्गीकृत नहीं किया गया है, क्योंकि यह भंगुर है, कमजोर रूप से विद्युत प्रवाह का संचालन करता है और प्रदर्शित करता है रासायनिक गुणअधातु।
संरचना क्रिस्टलीय सिलिकॉनहीरे की संरचना के समान। उनके क्रिस्टल में, प्रत्येक परमाणु चार अन्य सहसंयोजक बंधों से जुड़ा होता है। इसके अलावा, हीरे में कार्बन परमाणुओं के बीच सिलिकॉन परमाणुओं के बीच सहसंयोजक बंधन बहुत कमजोर है। सामान्य परिस्थितियों में भी, कुछ बंधन नष्ट हो जाते हैं और मुक्त इलेक्ट्रॉन दिखाई देते हैं, जो एक छोटी विद्युत चालकता का कारण बनते हैं। जब गर्म और प्रकाशित किया जाता है, तो टूटे हुए बंधनों की संख्या बढ़ जाती है, इसलिए अधिक मुक्त इलेक्ट्रॉन दिखाई देते हैं, और विद्युत चालकता बढ़ जाती है।
क्रिस्टलीय सिलिकॉन एक अर्धचालक है। अर्धचालक वे पदार्थ होते हैं जिनकी विद्युत चालकता धातुओं और डाइलेक्ट्रिक्स की चालकता के बीच मध्यवर्ती होती है। आप हाई स्कूल भौतिकी के पाठों में इस घटना का अधिक विस्तार से अध्ययन करेंगे। यह संपत्ति एसी रेक्टीफायर और सौर पैनलों के निर्माण में सिलिकॉन के उपयोग का आधार है जो सूर्य की तापीय ऊर्जा को विद्युत ऊर्जा में परिवर्तित करती है। ऐसी बैटरियां कृत्रिम पृथ्वी उपग्रहों पर स्थापित की जाती हैं और इनका उपयोग जमीन पर भी किया जाता है।
सिलिकॉन (अनाकार और क्रिस्टलीय) की विभिन्न संरचना भी अलॉट्रोपिक संशोधनों की विभिन्न रासायनिक गतिविधि को निर्धारित करती है। सामान्य परिस्थितियों में, क्रिस्टलीय सिलिकॉन अक्रिय होता है, जबकि अनाकार सिलिकॉन फ्लोरीन में जलता है:

गर्म होने पर, सिलिकॉन कई गैर-धातुओं (ऑक्सीजन, क्लोरीन, नाइट्रोजन, कार्बन, सल्फर) के साथ संपर्क करता है और निकल जाता है एक बड़ी संख्या कीगरमाहट। सिलिकॉन धातुओं के साथ जोड़ती है। इन यौगिकों को सिलिसाइड्स कहा जाता है।
व्यायाम।टास्क 1। उपयुक्त प्रतिक्रिया समीकरण लिखें और रेडॉक्स प्रतिक्रियाओं में सिलिकॉन के कार्यों को इंगित करें।
कार्य 2।मैग्नीशियम, एल्युमिनियम के साथ सिलिकॉन की रासायनिक अभिक्रियाओं के समीकरण लिखिए। ऑक्सीकरण एजेंट, कम करने वाले एजेंट को निर्दिष्ट करें। पता करें कि सिलिकॉन किस ऑक्सीकरण अवस्था को प्रदर्शित करता है।
एसिड (हाइड्रोफ्लोरिक एचएफ को छोड़कर) सिलिकॉन पर कार्य नहीं करते हैं, हालांकि, जब क्षार धातु हाइड्रॉक्साइड सिलिकॉन के साथ जुड़े होते हैं, तो सिलिकिक एसिड का नमक बनता है - सिलिकेट और हाइड्रोजन:
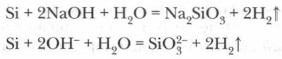
पर उच्च तापमानसिलिकॉन अपने आक्साइड से कई धातुओं को पुनर्स्थापित करता है:
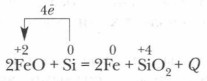
सिलिकॉन प्रकृति में अपने शुद्ध रूप में नहीं पाया जाता है।
सिलिकॉन को पहली बार 1822 में स्वीडिश वैज्ञानिक आई. बर्जेलियस द्वारा 400 डिग्री सेल्सियस तक गर्म करने पर पोटेशियम धातु के साथ सिलिकॉन फ्लोराइड SiF 4 को कम करके प्राप्त किया गया था। धात्विक मैग्नीशियम के साथ SiO2 को कम करके इसे प्राप्त करना और भी आसान है:
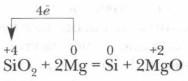
उद्योग में, सिलिकॉन आमतौर पर रेत और कोक के मिश्रण को गर्म करके प्राप्त किया जाता है:
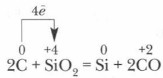
कम सिलिकॉन आंशिक रूप से अतिरिक्त कार्बन के साथ प्रतिक्रिया करता है कारबरंडमकार्बोरंडम में हीरे की तरह क्रिस्टल जाली होती है, इसमें सहसंयोजक बंधन बहुत मजबूत होते हैं, इसलिए यह कठोरता में हीरे के करीब होता है, और इसका उपयोग ग्राइंडस्टोन और ग्राइंडिंग व्हील बनाने के लिए किया जाता है।
व्यायाम। SiC - सिलिकॉन कार्बाइड या कार्बन सिलिसाइड का सही नाम क्या है? तर्कपूर्ण उत्तर दीजिए।
सिलिकॉन यौगिक
प्रकृति में, सिलिकॉन मुख्य रूप से सिलिका (रेत) SiO2 और सिलिकेट के रूप में पाया जाता है। सिलिकॉन ऑक्साइड (IV) के शुद्ध क्रिस्टल कई बहुरूपी संशोधनों का निर्माण करते हैं, जिनमें से एक क्वार्ट्ज है, जो रॉक क्रिस्टल के रूप में होता है। सुंदर रंगीन क्वार्ट्ज क्रिस्टल (नीलम, धुएँ के रंग का पुखराज, काला मोरियन, कारेलियन, अगेट, ओपल, जैस्पर, आदि) अर्ध-कीमती पत्थर हैं।
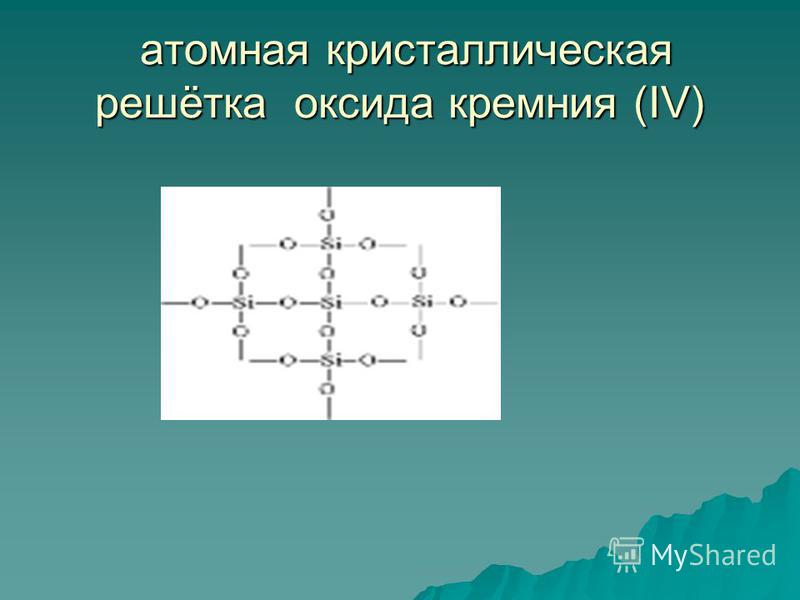
सिलिकॉन (चतुर्थ) ऑक्साइड SiO 2 एक ठोस अपवर्तक पदार्थ है (पिघलने बिंदु 1713 डिग्री सेल्सियस), पानी में अघुलनशील (चित्र 54)। उसका स्वामित्व परमाणुक्रिस्टल जाली (चित्र। 55): यहाँ कोई अणु नहीं हैं, प्रत्येक सिलिकॉन परमाणु के पास चार ऑक्सीजन परमाणु स्थित हैं - एक प्रकार का स्थानिक ढांचा. क्वार्ट्ज का एक टुकड़ा एक विशाल अणु की तरह होता है। क्वार्ट्ज एक अकार्बनिक बहुलक है, इसका सूत्र (SiO2) n है।
पीएससीई की विशेषताएं 1. पीएससीई में स्थिति। 1. पीएससीई में स्थिति। 4 समूह, मुख्य उपसमूह, 4 समूह, मुख्य उपसमूह, 3 अवधि। 3 पंक्ति 3 अवधि। 3 पंक्ति Ar=28 Ar=28 ऑक्सीकरण अवस्था: ऑक्सीकरण अवस्था: -4, ऑक्साइड: ऑक्साइड: SiO (उदासीन) SiO (उदासीन) SiO 2 (अम्लीय) SiO 2 (अम्लीय) सिलिकिक अम्ल सिलिकिक अम्ल H 2 SiO 3 H 2 SiO 3
Z=+14 Z= p=14 +1 p=14 0 n=28-14=14 0 n=28-14=14 e=14 e=14 +14) 2) 8) 4 +14) 2) 8 ) एस 2एस 2पी 3एस 3पी

सिलिकॉन तीसरा (ऑक्सीजन और हाइड्रोजन के बाद) सिलिकॉन में तीसरा (ऑक्सीजन और हाइड्रोजन के बाद) सबसे प्रचुर मात्रा में तत्व है: यह तत्व की प्रचुरता के लिए जिम्मेदार है: यह पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 16.7% है। पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 16.7%। प्रकृति में, सिलिकॉन केवल सिलिकिक एसिड (सिलिकेट) के डाइऑक्साइड और लवण के रूप में होता है। एल्युमिनोसिलिकेट सबसे व्यापक हैं। प्रकृति में, सिलिकॉन केवल सिलिकिक एसिड (सिलिकेट) के डाइऑक्साइड और लवण के रूप में होता है। एल्युमिनोसिलिकेट सबसे व्यापक हैं।

बेसिक सिलिकॉन मिनरल्स बेसिक सिलिकॉन मिनरल्स Al 2 O 3 *2SiO 2 *2H 2 O – सफेद चिकनी मिट्टी Al 2 O 3 * 2SiO 2 * 2H 2 O - सफेद मिट्टी K 2 O * Al 2 O 3 * SiO 2 - फेल्डस्पार K 2 O * Al 2 O 3 * SiO 2 - फेल्डस्पार K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - अभ्रक K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - अभ्रक SiO 2 - सिलिका या नदी की रेत SiO 2 - सिलिका या नदी की रेत

खनिजों और चट्टानों के साम्राज्य में सिलिकॉन मुख्य तत्व है। ज्यादातर यह क्वार्ट्ज खनिजों (जिनकी किस्में चकमक पत्थर, सिलिका (रेत), अगेट, जैस्पर) और रॉक क्रिस्टल (जिनकी किस्में हैं: नीलम, धुएँ के रंग का पुखराज) के रूप में पाया जाता है। खनिजों और चट्टानों के साम्राज्य में सिलिकॉन मुख्य तत्व है। ज्यादातर यह क्वार्ट्ज खनिजों (जिनकी किस्में चकमक पत्थर, सिलिका (रेत), अगेट, जैस्पर) और रॉक क्रिस्टल (जिनकी किस्में हैं: नीलम, धुएँ के रंग का पुखराज) के रूप में पाया जाता है। सिलिकॉन लगभग कभी भी मुक्त रूप में नहीं पाया जाता है। सिलिकॉन लगभग कभी भी मुक्त रूप में नहीं पाया जाता है।

कुछ समुद्री जीव बड़ी मात्रा में सिलिकॉन जमा करते हैं। कुछ समुद्री जीव बड़ी मात्रा में सिलिकॉन जमा करते हैं। उनमें समृद्ध समुद्री पौधों में डायटम शामिल हैं, और जानवरों से, रेडिओलेरियन और सिलिकॉन स्पंज में बहुत अधिक सिलिकॉन होता है। उनमें समृद्ध समुद्री पौधों में डायटम शामिल हैं, और जानवरों से, रेडिओलेरियन और सिलिकॉन स्पंज में बहुत अधिक सिलिकॉन होता है।

A. उद्योग में - बिजली की भट्टियों में कोयले से रिकवरी a. उद्योग में - बिजली की भट्टियों में कोयले से कमी SiO 2 +2C=Si+2CO SiO 2 +2C=Si+2CO ख। प्रयोगशाला में - सिलिका का धातु अपचयन b. प्रयोगशाला में - सिलिका धातुओं की कमी 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3

1) अनाकार सिलिकॉन - भूरा पाउडर 1) अनाकार सिलिकॉन - भूरा पाउडर पिघलने वाला टी 1420 सी। पिघलने वाला टी 1420 सी। 2) क्रिस्टलीय सिलिकॉन - एक मामूली धातु की चमक के साथ एक ठोस, गहरे भूरे रंग का, गर्मी और विद्युत चालकता है 2) क्रिस्टलीय सिलिकॉन - ठोस, गहरे भूरे रंग में थोड़ी धात्विक चमक के साथ, तापीय और विद्युत चालकता होती है

ए) के साथ बातचीत सरल पदार्थ. ए) सरल पदार्थों के साथ बातचीत। Si रिड्यूसिंग एजेंट Si रिड्यूसिंग एजेंट 1) हैलोजन के साथ 1) हैलोजन के साथ Si+2F 2 =SF 4 - सिलिकॉन फ्लोराइड Si+2F 2 =SF 4 - सिलिकॉन फ्लोराइड 2) ऑक्सीजन के साथ 2) ऑक्सीजन के साथ Si+O 2 SiO 2 ऑक्साइड सिलिकॉन (lV) Si + O 2 SiO 2 - सिलिकॉन ऑक्साइड (lV) 3) नाइट्रोजन 3 के साथ) नाइट्रोजन के साथ 3Si + 2N 2 = Si 3 N 4 - सिलिकॉन नाइट्राइड 3Si + 2N 2 = Si 3 N 4 - सिलिकॉन नाइट्राइड 4) के साथ कार्बन 4) कार्बन सी + सी = सीआईसी - सिलिकॉन कार्बाइड या सी + सी = सीआईसी - सिलिकॉन कार्बाइड या कार्बोरंडम कार्बोरंडम के साथ

Si-oxidizer Si-oxidizer 5) धातुओं के साथ 5) धातुओं के साथ Si + 2Mg \u003d t Mg 2 Si - मैग्नीशियम सिलिसाइड Si + 2Mg \u003d t Mg 2 Si - मैग्नीशियम सिलिसाइड सिलिकॉन सीधे हाइड्रोजन के साथ प्रतिक्रिया नहीं करता है। सिलिकॉन सीधे हाइड्रोजन के साथ प्रतिक्रिया नहीं करता है। SiH4 अप्रत्यक्ष रूप से प्राप्त किया जाता है। SiH4 अप्रत्यक्ष रूप से प्राप्त किया जाता है। Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (साइलेन, जहरीली गैस) (साइलेन, जहरीली गैस)

बी) जटिल पदार्थों के साथ बातचीत 1) हाइड्रोजन हलाइड्स से, प्रतिक्रिया केवल एचएफ 1 के साथ आगे बढ़ती है) हाइड्रोजन हलाइड्स से प्रतिक्रिया केवल एचएफ सी + 4 एचएफ = सीआईएफ 4 + 2 एच 2 सी + 4 एचएफ = सीआईएफ 4 + 2 एच 2 2 के साथ आगे बढ़ती है) एसिड से, प्रतिक्रिया केवल नाइट्रिक और हाइड्रोफ्लोरिक 2 के मिश्रण से होती है) एसिड से, प्रतिक्रिया केवल नाइट्रिक और हाइड्रोफ्लोरिक 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + के मिश्रण से होती है। 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O अन्य अम्लों की क्रिया के तहत सिलिकॉन की सतह पर SiO 2 की एक घनी ऑक्साइड फिल्म बनती है। अन्य अम्लों की क्रिया के तहत, SiO 2 की एक घनी ऑक्साइड फिल्म बनती है सिलिकॉन की सतह 3) क्षार 3 के साथ परस्पर क्रिया) क्षार + H 2 O \u003d Na 2 SiO 3 + 2H 2 के साथ परस्पर क्रिया

खोलना। 1834 में, रूसी रसायनज्ञ हेस ने इस तत्व को अपना रूसी नाम दिया। 1834 में, रूसी रसायनज्ञ हेस ने इस तत्व को अपना रूसी नाम दिया। सिलिकॉन की खोज 1825 में स्वीडिश रसायनज्ञ बर्जेलियस द्वारा 1825 में सिलिकॉन की खोज की गई थी। बर्जेलियस।

अनुप्रयोग इसका उपयोग इंजीनियरिंग में सेमीकंडक्टर सामग्री और मिश्र धातुओं के उत्पादन के लिए किया जाता है। धातु काटने वाली मशीनों के लिए कांच और सीमेंट, कटर के उत्पादन के लिए भी। इसका उपयोग इंजीनियरिंग में सेमीकंडक्टर सामग्री और मिश्र धातु प्राप्त करने के लिए किया जाता है। धातु काटने वाली मशीनों के लिए कांच और सीमेंट, कटर के उत्पादन के लिए भी।

सिलिकॉन (IV) ऑक्साइड या सिलिका सिलिकॉन (IV) ऑक्साइड या सिलिका 1. संरचना: सिलिकॉन (IV) ऑक्साइड में आणविक (कार्बन डाइऑक्साइड की तरह) नहीं है, लेकिन एक परमाणु क्रिस्टल जाली है 1. संरचना: सिलिकॉन (IV) ऑक्साइड में एक गैर है -आण्विक (कार्बन डाइऑक्साइड की तरह), लेकिन परमाणु क्रिस्टल जाली। ). जो हाइड्रोफ्लोरिक (हाइड्रोहालिक एसिड याद रखें) को छोड़कर पानी और एसिड में अघुलनशील है।