Räni asukoht keemiliste elementide perioodilisuse tabelis
Seerianumber - 14, tuumalaeng +14, prootonid tuumas - 14, elektronid - 14. Perioodi number III - 14 elektroni liiguvad mööda kolme energiataset. Rühm number IV - välisel energiatasemel on 4 elektroni. Aatomi raadius on suurem kui süsinikul – elektronide tagastamise võime suureneb. Suurenenud metallilised ja redutseerivad omadused (võrreldes süsinikuga). Si Ge Sn Pb. üldised omadused räni positsiooni järgi perioodilises süsteemis. C.
Pilt 2 esitlusest "Räni" keemiatundi teemal "Räni"Mõõdud: 960 x 720 pikslit, formaat: jpg. Keemiatunni jaoks pildi tasuta allalaadimiseks paremklõpsake pildil ja klõpsake nuppu "Salvesta pilt kui...". Tunnis piltide näitamiseks saab tasuta alla laadida ka täispika esitluse "Silicon.ppt" koos kõigi piltidega zip-arhiivis. Arhiivi suurus - 562 KB.
Laadige esitlus allaRäni
"Räni õppetund" – Süsinikdioksiid endast ja inimkonnast. Töö paaris, vastastikune kontroll - vigu pole (5), kaks viga (4) jne. 3% õhus - pearinglus, tinnitus, unisus. 20% on inimestele surmav. Mittemetalliliste ja metalliliste omaduste avaldumise kohta. Meeskonna reiting. Mida saab öelda süsiniku ja plii aatomiraadiuste suuruse kohta?
"Räni ja selle ühendid" – kaaluge räni looduslikke ühendeid. Kirjeldage elementi räni. Räni hankimine. Räni avastasid esmakordselt 1811. aastal Gay-Lussac ja Tenard. Aatomite ehitus ja omadused. Erinevalt süsinikmonooksiidist (IV) ei suhtle ränioksiid veega. Pooljuht. sulamistemperatuur (Si) = 1415 °C, sulamistemperatuur (teemant) = 3730 °C.
"Räni isotoobid" – polükristallilise räni saamine. Ramani riba maksimumi asukoha sõltuvus aatommassist. Põleti. Ühekristallilise seemne tootmine. Tsooni puhastatud räni. Kaitsev kate. Isotoopiliselt rikastatud räni-28 soojusjuhtivus. Kasvavad üksikud kristallid. Isotoopide kontsentratsiooni jaotus seemne pikkuses.
"Räniühendid" - kvartsi sordid. Jaspis. Silikaatide saamine. looduslikud silikaadid. ränioksiid. SiO2 baasil mineraalid. SiO2 keemilised omadused. Räni avastamine. Räni ja selle ühendid. Räni. Ahhaat. Oksüdatsiooniaste. Elektrooniline konfiguratsioon. silikaadid ja vesinik. Rhinestone. Looduses leidmine. Silane.
"Süsinik ja räni" - Keemilised omadused. Tahkete ainete seas üks pehmemaid. silikaattellised. Seda segu nimetatakse tootjagaasiks. Joon.1 Teemantvõre mudel. Saadud gaas koosneb vabast lämmastikust ja süsinikmonooksiidist (II). Üle 99% atmosfääris leiduvast süsinikust on süsinikdioksiidi kujul. Koht PSHE-s.
"Räni" – enne välimise taseme valmimist puudub ränil 4 elektroni. Räni (IV) oksiid. Räni üldised omadused positsiooni järgi perioodilisuse süsteemis. Laborites saadakse räni ränioksiidi SiO2 redutseerimisel. füüsikalised omadused. Silikaadid on ränihappe soolad. silikaaditööstus.
Kokku on teemas 6 ettekannet
Siit saate alla laadida õppetunni teemal: "Süsiniku ja räni positsioon perioodilises süsteemis keemilised elemendid, nende aatomite struktuur. Süsinik, allotroopsed modifikatsioonid" õppeaine jaoks: keemia. See dokument aitab teil tunni jaoks ette valmistada hea ja kvaliteetse materjali.
Kuupäev _____________ klass _______________
Teema: Süsiniku ja räni asend keemiliste elementide perioodilises süsteemis, nende aatomite ehitus. Süsinik, allotroopsed modifikatsioonid.
| Aatomi ehituse skeem | Viimase energiataseme elektrooniline struktuur | Suurepärane oksiidvalemRO 2 | Lenduva vesiniku ühendi valem RH 4 | |
| 1. Süsinik | C+6) 2 ) 4 | …2 s 2 2 lk 2 | C +4 O 2 | C -4 H 4 |
| 2. Räni | Si +14) 2 ) 8 ) 4 | …3 s 2 3 lk 2 | Si +4 O 2 | Si -4 H 4 |
Nagu aatomite struktuuri skeemidelt näha, on nende elementide välisenergia tasemel 4 elektroni, seetõttu on süsiniku ja räni oksüdatsiooniaste +4 ja -4.
Diagrammilt on näha, et süsiniku ruumala välistasandil on kaks paaristamata elektroni (sarnaselt räni). See selgitab, et süsiniku ja räni oksüdatsiooniaste võib olla +2 (näiteks CO on süsinikoksiid). Ergastatud olekusse minnes võib üks s-elektronidest minna vabale p-orbitaalile. Siis ilmub aatomitesse 4 paaritut elektroni ja oksüdatsiooniaste on +4 ja -4.
2. Muutke alamrühma omadusi
Süsiniku alarühmas suureneb seerianumbri suurenemisega aatomite tuuma laeng, välistasandi elektronide arv on konstantne, aatomite energiatasemete arv suureneb ja aatomi raadius suureneb süsinikust plii suunas, nõrgeneb negatiivsete elektronide külgetõmbejõud positiivsesse tuuma ja suureneb elektronide loovutamise võime ning sellest tulenevalt süsiniku alarühmas seerianumbri suurenemisega mittemetallilised omadused vähenevad ja metallilised omadused suurenevad.
C ja Si on mittemetallid, Ge on pooljuht, Sn ja Pb on metallid.
SÜSI. SÜSINIKU ALLOTRPOPIA
Süsinikku leidub looduses, nii vabas vormis kui ka ühenditena. See esineb vabas vormis as allotroopsed modifikatsioonid– teemant, grafiit, karabiin, fullereen.
Teemant
Kristalne aine, läbipaistev, murdub tugevalt valguskiiri, väga tahke, ei juhi elektrivoolu, juhib halvasti soojust, ρ = 3,5 g/cm3; t°pl. = 3730 °C; t° keema = 4830 °C.
Saab grafiidist p > 50 tuh atm; t° = 1200°C.
Rakendus:
Lihvimispulber, puurid, klaasilõikurid, pärast lõikamist - teemandid.
Grafiit
Kristalne aine, kihiline, läbipaistmatu, tumehall, metallilise läikega, pehme, juhib elektrivoolu; ρ \u003d 2,5 g / cm3.
Rakendus:
Elektroodid, pliiatsijuhtmed, neutronite moderaator tuumareaktorites on osa mõnedest määrdeainetest.
Karabiin
Must pulber; ρ \u003d 2 g / cm 3; pooljuht.
Koosneb lineaarsetest ahelatest –C≡C–C≡C– ja =C=C=C=C=.
Kuumutamisel muutub see grafiidiks.
ÕppetundRäni on maakoore kõige olulisem element, levimuse poolest on ta hapniku järel teisel kohal (ca 27,6%).
Ränil on kolm isotoopi: i (92,27%); (4,68%); (3,05%).
Ränil on kaks allotroopset modifikatsiooni: amorfne Ja kristall. Struktuuri erinevus määrab ka erinevuse füüsikalised omadused need modifikatsioonid. Amorfne räni- pruun pulber, millel puudub kindel sulamistemperatuur. Kristalliline räni poolt välimus sarnane metalliga, tumehall, metallilise läikega, tulekindel (sulamistemperatuur 1400 ° C), kuid seda ei klassifitseerita metalliks, kuna see on rabe, juhib nõrgalt elektrivoolu ja sellel on Keemilised omadused mittemetallid.
Struktuur kristalne räni sarnane teemandi struktuuriga. Tema kristallis on iga aatom ühendatud nelja teise kovalentse sidemega. Pealegi on räni aatomite vaheline kovalentne side palju nõrgem kui teemandi süsinikuaatomite vahel. Ka tavatingimustes osa sidemeid hävib ja tekivad vabad elektronid, mis põhjustavad väikese elektrijuhtivuse. Kuumutamisel ja valgustamisel suureneb katkenud sidemete arv, mistõttu ilmub rohkem vabu elektrone ja suureneb elektrijuhtivus.
Kristalliline räni on pooljuht. Pooljuhid on ained, mille elektrijuhtivus on metallide ja dielektrikute juhtivuse vahepealne. Lähemalt uurite seda nähtust keskkooli füüsikatundides. See omadus on aluseks räni kasutamisele vahelduvvoolu alaldid ja päikesepaneelid, mis muudavad päikese soojusenergia elektrienergiaks. Sellised akud paigaldatakse Maa tehissatelliitidele ja neid kasutatakse ka maapinnal.
Räni erinev struktuur (amorfne ja kristalne) määrab ka allotroopsete modifikatsioonide erineva keemilise aktiivsuse. Normaaltingimustes on kristalne räni inertne, amorfne räni aga põleb fluoris:

Kuumutamisel interakteerub räni paljude mittemetallidega (hapnik, kloor, lämmastik, süsinik, väävel) ja vabaneb suur hulk soojust. Räni ühineb metallidega. Neid ühendeid nimetatakse silitsiidiks.
Harjutus.Ülesanne 1. Kirjutage sobivad reaktsioonivõrrandid ja märkige räni funktsioonid redoksreaktsioonides.
2. ülesanne. Kirjutage räni keemiliste reaktsioonide võrrandid magneesiumi, alumiiniumiga. Määrake oksüdeerija, redutseerija. Uurige, millises oksüdatsiooniastmes räni on.
Happed (va vesinikfluoriid-HF) ränile ei mõju, kuid leelismetallihüdroksiidide sulatamisel räniga moodustub ränihappe sool - silikaat ja vesinik:
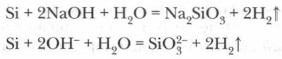
Kell kõrge temperatuur räni taastab paljud metallid nende oksiididest:
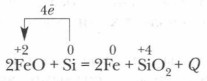
Räni puhtal kujul looduses ei leidu.
Räni sai esmakordselt 1822. aastal Rootsi teadlane I. Berzelius, redutseerides ränifluoriidi SiF 4 kaaliummetalliga, kui seda kuumutati temperatuurini 400 °C. Seda on veelgi lihtsam saada, redutseerides SiO 2 metallilise magneesiumiga:
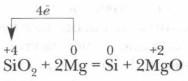
Tööstuses saadakse räni tavaliselt liiva ja koksi segu kuumutamisel:
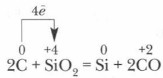
Redutseeritud räni reageerib osaliselt liigse süsinikuga, moodustades karborund Karborundumil on teemantitaoline kristallvõre, selles sisalduvad kovalentsed sidemed on väga tugevad, seega on see kõvaduse poolest teemandilähedane ning seda kasutatakse lihvkivide ja lihvketaste valmistamiseks.
Harjutus. Mis on SiC õige nimetus – ränikarbiid või süsiniksilitsiid? Andke põhjendatud vastus.
Räniühendid
Looduses leidub räni peamiselt ränidioksiidi (liiva) SiO 2 ja silikaatide kujul. Ränioksiidi (IV) puhtad kristallid moodustavad mitmeid polümorfseid modifikatsioone, millest üks on kvarts, mis esineb mäekristallidena. Kaunivärvilised kvartskristallid (ametüst, suitsune topaas, must morioon, karneool, ahhaat, opaal, jaspis jt) on poolvääriskivid.
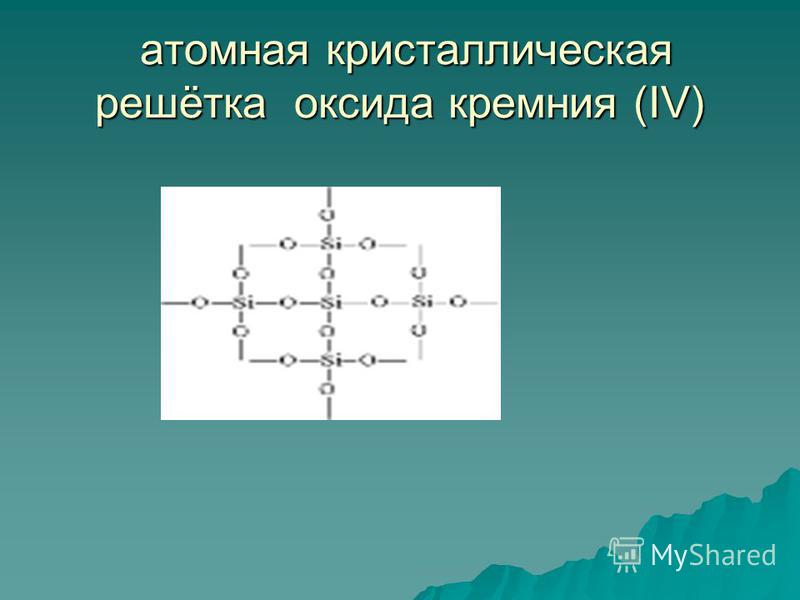
Räni(IV)oksiid SiO 2 on tahke tulekindel aine (sulamistemperatuur 1713 °C), vees lahustumatu (joonis 54). Ta valdab aatomi kristallvõre (joon. 55): siin pole molekule, iga räni aatomi läheduses asub neli hapnikuaatomit - omamoodi ruumiline raamistik. Kvartsitükk on nagu üks hiiglaslik molekul. Kvarts on anorgaaniline polümeer, selle valem on (SiO 2) n.
PSCE omadused 1. Amet PSCEs. 1. Ametikoht PSCE-s. 4 rühm, põhialarühm, 4 rühm, põhialarühm, 3 periood. 3 rida 3 periood. 3 rida Ar=28 Ar=28 oksüdatsiooniaste: oksüdatsiooniaste: -4, oksiidid: oksiidid: SiO (ükskõikne) SiO (ükskõikne) SiO 2 (happeline) SiO 2 (happeline) Ränihape Ränihape H 2 SiO 3 H 2 SiO 3
Z=+14 Z= p=14 +1 p=14 0 n=28-14=14 0 n=28-14=14 e=14 e=14 +14) 2) 8) 4 +14) 2) 8 ) S 2S 2P 3S 3P

Räni on kolmas (hapniku ja vesiniku järel), räni on kolmas (hapniku ja vesiniku järel) kõige levinumalt element: see moodustab elemendi arvukuse: see moodustab 16,7% maakoore aatomite koguarvust. 16,7% maakoore aatomite koguarvust. Looduses esineb räni ainult dioksiidide ja ränihappesoolade (silikaatide) kujul. Alumosilikaadid on kõige levinumad. Looduses esineb räni ainult dioksiidide ja ränihappesoolade (silikaatide) kujul. Alumosilikaadid on kõige levinumad.

Põhilised räni mineraalid Põhilised räni mineraalid Al 2 O 3 *2SiO 2 *2H 2 O – Valge savi Al 2 O 3 * 2SiO 2 * 2H 2 O - valge savi K 2 O * Al 2 O 3 * SiO 2 - päevakivi K 2 O * Al 2 O 3 * SiO 2 - päevakivi K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - vilgukivi K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - vilgukivi SiO 2 - ränidioksiid või jõeliiv SiO 2 - ränidioksiid või jõeliiv

Räni on mineraalide ja kivimite kuningriigi põhielement. Kõige sagedamini leidub seda kvartsmineraalide kujul (mille sordid on tulekivi, ränidioksiid (liiv), ahhaat, jaspis) ja mäekristall (mille sordid on: ametüst, suitsune topaas). Räni on mineraalide ja kivimite kuningriigi põhielement. Kõige sagedamini leidub seda kvartsmineraalide kujul (mille sordid on tulekivi, ränidioksiid (liiv), ahhaat, jaspis) ja mäekristall (mille sordid on: ametüst, suitsune topaas). Räni ei leidu peaaegu kunagi vabas vormis. Räni ei leidu peaaegu kunagi vabas vormis.

Mõned mereorganismid koguvad räni suurtes kogustes. Mõned mereorganismid koguvad räni suurtes kogustes. Nende poolest rikaste meretaimede hulka kuuluvad ränivetikad ning loomadelt sisaldavad radiolariaanid ja ränikäsnad palju räni. Nende poolest rikaste meretaimede hulka kuuluvad ränivetikad ning loomadelt sisaldavad radiolariaanid ja ränikäsnad palju räni.

A. tööstuses - taaskasutamine söega elektriahjudes a. tööstuses - redutseerimine kivisöega elektriahjudes SiO 2 +2C=Si+2CO SiO 2 +2C=Si+2CO b. laboris - ränidioksiidi metalli redutseerimine b. laboris - ränidioksiidi metallide 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 redutseerimine

1) amorfne räni - pruun pulber 1) amorfne räni - pruun pulber sulamistemperatuur t 1420 C. sulav t 1420 C. 2) kristalne räni - tahke aine, tumehalli värvi, vähese metallilise läikega, soojus- ja elektrijuhtivusega 2) kristalne räni - tahke, tumehall, kerge metallilise läikega, soojus- ja elektrijuhtivusega

A) suhtlemine lihtsad ained. a) koostoime lihtainetega. Si redutseerija Si redutseerija 1) halogeenidega 1) halogeenidega Si+2F 2 =SF 4 - ränifluoriid Si+2F 2 =SF 4 - ränifluoriid 2) hapnikuga 2) hapnikuga Si+O 2 SiO 2 oksiid räni (lV) Si + O 2 SiO 2 - ränioksiid (lV) 3) lämmastikuga 3) lämmastikuga 3Si + 2N 2 = Si 3 N 4 - räni nitriid 3Si + 2N 2 = Si 3 N 4 - räni nitriid 4) koos süsinik 4) süsinikuga Si + C= SiC - ränikarbiid või Si + C= SiC - ränikarbiid või karborund karborund

Si-oksüdeerija Si-oksüdeerija 5) metallidega 5) metallidega Si + 2Mg \u003d t Mg 2 Si - magneesiumsilitsiid Si + 2Mg \u003d t Mg 2 Si - magneesiumsilitsiid Räni ei reageeri otseselt vesinikuga. Räni ei reageeri otseselt vesinikuga. SiH4 saadakse kaudselt. SiH4 saadakse kaudselt. Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (silaan, mürkgaas) (silaan, mürkgaas)

B) interaktsioon kompleksainetega 1) vesinikhalogeniididest, reaktsioon kulgeb ainult HF-ga 1) vesinikhalogeniididega, reaktsioon kulgeb ainult HF-ga Si + 4HF = SiF 4 + 2H 2 Si + 4HF = SiF 4 + 2H 2 2) hapetest toimub reaktsioon ainult lämmastik- ja vesinikfluoriidhappe seguga 2) hapetest, reaktsioon kulgeb ainult lämmastik- ja fluoriidhappe 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + seguga 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O Teiste hapete toimel tekib räni pinnale tihe SiO 2 oksiidkile Teiste hapete toimel moodustub pinnale tihe SiO 2 oksiidkile. räni pind 3) interaktsioon leelistega 3) interaktsioon leelistega + H 2 O \u003d Na 2 SiO 3 + 2H 2

Avamine. 1834. aastal andis vene keemik Hess sellele elemendile venekeelse nime. 1834. aastal andis vene keemik Hess sellele elemendile venekeelse nime. Räni avastati Räni avastas 1825. aastal Rootsi keemik Berzelius 1825. aastal. Berzelius.

Kasutamine Seda kasutatakse inseneritöös pooljuhtmaterjalide ja -sulamite tootmiseks. Samuti klaasi ja tsemendi tootmiseks, metallilõikusmasinate lõikurid. Seda kasutatakse inseneritöös pooljuhtmaterjalide ja -sulamite saamiseks. Samuti klaasi ja tsemendi tootmiseks, metallilõikusmasinate lõikurid.

Räni(IV)oksiid ehk ränidioksiid Räni(IV)oksiid ehk ränidioksiid 1. Struktuur: Räni(IV)oksiidil ei ole molekulaarset (nagu süsinikdioksiid), vaid aatomkristallvõre 1. Struktuur: Räni(IV)oksiidil on mitte -molekulaarne (nagu süsihappegaas), kuid aatomkristallvõre Seetõttu on SiO 2 tahke ja tulekindel aine, Seetõttu on SiO 2 tahke ja tulekindel aine, mis ei lahustu vees ja hapetes, välja arvatud vesinikfluoriid (meenutagem vesinikhalogeniidhappeid ). Mis ei lahustu vees ja hapetes, välja arvatud vesinikfluoriid (meenutagem vesinikhalogeniidhappeid).