रासायनिक तत्वों की आवर्त सारणी में सिलिकॉन की स्थिति
क्रम संख्या - 14, परमाणु आवेश +14, नाभिक में प्रोटॉन - 14, इलेक्ट्रॉन - 14। अवधि संख्या III - 14 इलेक्ट्रॉन तीन ऊर्जा स्तरों पर चलते हैं। समूह संख्या IV - बाहरी ऊर्जा स्तर में 4 इलेक्ट्रॉन होते हैं। परमाणु की त्रिज्या कार्बन से अधिक होने पर इलेक्ट्रॉन लौटाने की क्षमता बढ़ जाती है। धात्विक और अपचायक गुणों में वृद्धि (कार्बन की तुलना में)। सी जीई एसएन पीबी. सामान्य विशेषताएँआवधिक प्रणाली में स्थिति के अनुसार सिलिकॉन। सी।
प्रस्तुति "सिलिकॉन" से चित्र 2"सिलिकॉन" विषय पर रसायन शास्त्र के पाठ के लिएआयाम: 960 x 720 पिक्सेल, प्रारूप: jpg. रसायन विज्ञान पाठ के लिए एक चित्र निःशुल्क डाउनलोड करने के लिए, छवि पर राइट-क्लिक करें और "छवि को इस रूप में सहेजें..." पर क्लिक करें। पाठ में चित्र दिखाने के लिए, आप ज़िप संग्रह में सभी चित्रों के साथ पूर्ण प्रस्तुति "सिलिकॉन.पीपीटी" भी निःशुल्क डाउनलोड कर सकते हैं। पुरालेख का आकार - 562 KB.
प्रस्तुतिकरण डाउनलोड करेंसिलिकॉन
"सिलिकॉन पाठ" - अपने और मानवता के बारे में कार्बन डाइऑक्साइड। जोड़ियों में काम करें, आपसी जाँच - कोई त्रुटि नहीं (5), दो त्रुटियाँ - (4), आदि। हवा में 3% - चक्कर आना, टिनिटस, उनींदापन। 20% मनुष्य के लिए घातक है। गैर-धात्विक और धात्विक गुणों की अभिव्यक्ति पर। टीम रेटिंग. कार्बन से लेड तक परमाणु त्रिज्या के आकार के बारे में क्या कहा जा सकता है?
"सिलिकॉन और उसके यौगिक" - सिलिकॉन के प्राकृतिक यौगिकों पर विचार करें। सिलिकॉन तत्व का वर्णन करें। सिलिकॉन प्राप्त करना. सिलिकॉन की खोज सबसे पहले 1811 में गे-लुसाक और टेनार्ड ने की थी। परमाणुओं की संरचना और गुण. कार्बन मोनोऑक्साइड (IV) के विपरीत सिलिकॉन ऑक्साइड, पानी के साथ क्रिया नहीं करता है। अर्धचालक. tmelt(Si)=1415 ?C, tmelt(हीरा)=3730 ?C.
"सिलिकॉन के आइसोटोप" - पॉलीक्रिस्टलाइन सिलिकॉन प्राप्त करना। परमाणु द्रव्यमान पर रमन बैंड की स्थिति की अधिकतम निर्भरता। बर्नर. एकल-क्रिस्टल बीज का उत्पादन। ज़ोन-शुद्ध सिलिकॉन। सुरक्षात्मक आवरण. समस्थानिक रूप से समृद्ध सिलिकॉन-28 की तापीय चालकता। एकल क्रिस्टल का बढ़ना। बीज की लंबाई के साथ आइसोटोप सांद्रता का वितरण।
"सिलिकॉन यौगिक" - क्वार्ट्ज की किस्में। जैस्पर. सिलिकेट प्राप्त करना। प्राकृतिक सिलिकेट. सिलिकॉन ऑक्साइड. SiO2 पर आधारित खनिज। SiO2 के रासायनिक गुण। सिलिकॉन की खोज. सिलिकॉन और उसके यौगिक. सिलिकॉन. अगेट। ऑक्सीकरण की डिग्री. इलेक्ट्रोनिक विन्यास। सिलिकेट्स और हाइड्रोजन। स्फटिक. प्रकृति में ढूँढना. सिलाने.
"कार्बन और सिलिकॉन" - रासायनिक गुण। ठोस पदार्थों में सबसे नरम में से एक। सिलिकेट ईंटें. इस मिश्रण को उत्पादक गैस कहते हैं। चित्र.1 हीरा जाली मॉडल। परिणामी गैस में मुक्त नाइट्रोजन और कार्बन मोनोऑक्साइड (II) होते हैं। वायुमंडल में 99% से अधिक कार्बन कार्बन डाइऑक्साइड के रूप में है। पीएसएचई में स्थिति.
"सिलिकॉन" - बाहरी स्तर के पूरा होने से पहले, सिलिकॉन में 4 इलेक्ट्रॉनों की कमी होती है। सिलिकॉन (IV) ऑक्साइड. आवधिक प्रणाली में स्थिति के अनुसार सिलिकॉन की सामान्य विशेषताएँ। प्रयोगशालाओं में, सिलिकॉन ऑक्साइड SiO2 को कम करके सिलिकॉन प्राप्त किया जाता है। भौतिक गुण। सिलिकेट्स सिलिकिक एसिड के लवण हैं। सिलिकेट उद्योग.
विषय में कुल मिलाकर 6 प्रस्तुतियाँ हैं
यहां आप इस विषय पर पाठ डाउनलोड कर सकते हैं: "आवधिक प्रणाली में कार्बन और सिलिकॉन की स्थिति रासायनिक तत्व, उनके परमाणुओं की संरचना। कार्बन, एलोट्रोपिक संशोधन" विषय के लिए: रसायन विज्ञान। यह दस्तावेज़ आपको पाठ के लिए एक अच्छी और उच्च गुणवत्ता वाली सामग्री तैयार करने में मदद करेगा।
दिनांक _____________ कक्षा _______________
विषय:रासायनिक तत्वों की आवधिक प्रणाली में कार्बन और सिलिकॉन की स्थिति, उनके परमाणुओं की संरचना। कार्बन, एलोट्रोपिक संशोधन।
| परमाणु की संरचना का आरेख | अंतिम ऊर्जा स्तर की इलेक्ट्रॉनिक संरचना | सुपीरियर ऑक्साइड फॉर्मूलाआरओ 2 | वाष्पशील हाइड्रोजन यौगिक सूत्र आरएच 4 | |
| 1. कार्बन | सी+6) 2 ) 4 | …2 एस 2 2 पी 2 | सी +4 हे 2 | सी -4 एच 4 |
| 2. सिलिकॉन | सी +14) 2 ) 8 ) 4 | …3 एस 2 3 पी 2 | सी +4 हे 2 | सी -4 एच 4 |
जैसा कि परमाणुओं की संरचना के आरेखों से देखा जा सकता है, इन तत्वों के बाहरी ऊर्जा स्तर में 4 इलेक्ट्रॉन होते हैं, इसलिए, कार्बन और सिलिकॉन +4 और -4 की ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
आरेख से देखा जा सकता है कि कार्बन आयतन में बाहरी स्तर पर दो अयुग्मित इलेक्ट्रॉन होते हैं (इसी तरह, सिलिकॉन)। यह बताता है कि कार्बन और सिलिकॉन की ऑक्सीकरण अवस्था +2 हो सकती है (उदाहरण के लिए, CO कार्बन मोनोऑक्साइड है)। उत्तेजित अवस्था में जाने पर, एस-इलेक्ट्रॉनों में से एक मुक्त पी-ऑर्बिटल में जा सकता है। तब परमाणुओं में 4 अयुग्मित इलेक्ट्रॉन प्रकट होते हैं और ऑक्सीकरण अवस्था +4 और -4 होती है।
2. उपसमूह में गुण बदलें
कार्बन उपसमूह में, क्रम संख्या बढ़ने के साथ, परमाणुओं के नाभिक का आवेश बढ़ता है, बाहरी स्तर पर इलेक्ट्रॉनों की संख्या स्थिर होती है, परमाणुओं में ऊर्जा स्तरों की संख्या बढ़ती है और परमाणु की त्रिज्या कार्बन से लेड तक बढ़ती है, सकारात्मक नाभिक के प्रति नकारात्मक इलेक्ट्रॉनों का आकर्षण कमजोर हो जाता है और इलेक्ट्रॉन दान करने की क्षमता बढ़ जाती है, और परिणामस्वरूप, कार्बन उपसमूह में, क्रम संख्या बढ़ने के साथ, गैर-धात्विक गुण कम हो जाते हैं, और धात्विक गुण बढ़ जाते हैं।
C और Si अधातु हैं, Ge एक अर्धचालक है, Sn और Pb धातु हैं।
कार्बन. कार्बन का आवंटन
कार्बन प्रकृति में पाया जाता है, मुक्त रूप और यौगिक दोनों में। यह मुक्त रूप में होता है एलोट्रोपिक संशोधन- हीरा, ग्रेफाइट, कार्बाइन, फुलरीन।
डायमंड
क्रिस्टलीय पदार्थ, पारदर्शी, प्रकाश किरणों को दृढ़ता से अपवर्तित करता है, बहुत ठोस, विद्युत प्रवाह का संचालन नहीं करता है, गर्मी का खराब संचालन करता है, ρ = 3.5 ग्राम/सेमी3; टी°पीएल. = 3730°C; उबलना = 4830°C.
ग्रेफाइट से p > 50 हजार एटीएम पर प्राप्त किया जा सकता है; t° = 1200°C.
आवेदन पत्र:
पीसने का पाउडर, ड्रिल, ग्लास कटर, काटने के बाद - हीरे।
सीसा
क्रिस्टलीय पदार्थ, स्तरित, अपारदर्शी, गहरा भूरा, धात्विक चमक वाला, मुलायम, विद्युत प्रवाह का संचालन करता है; ρ = 2.5 ग्राम/सेमी 3।
आवेदन पत्र:
परमाणु रिएक्टरों में इलेक्ट्रोड, पेंसिल लीड, न्यूट्रॉन मॉडरेटर, कुछ स्नेहक का हिस्सा हैं।
काबैन
काला पाउडर; ρ = 2 ग्राम/सेमी 3; अर्धचालक.
रैखिक श्रृंखलाओं से मिलकर बनता है -C≡C–C≡C– और =C=C=C=C=।
गर्म करने पर यह ग्रेफाइट में बदल जाता है।
पाठसिलिकॉन पृथ्वी की पपड़ी का सबसे महत्वपूर्ण तत्व है; व्यापकता के मामले में, यह ऑक्सीजन (लगभग 27.6%) के बाद दूसरे स्थान पर है।
सिलिकॉन के तीन समस्थानिक हैं: i (92.27%); (4.68%); (3.05%).
सिलिकॉन दो एलोट्रोपिक संशोधनों में मौजूद है: बेढबऔर क्रिस्टल. संरचना में अंतर भी अंतर निर्धारित करता है भौतिक गुणये संशोधन. अनाकार सिलिकॉन- भूरा पाउडर, इसका कोई निश्चित गलनांक नहीं होता। क्रिस्टलीय सिलिकॉन द्वारा उपस्थितिधातु के समान, धात्विक चमक के साथ गहरा भूरा, दुर्दम्य (गलनांक 1400 डिग्री सेल्सियस), लेकिन इसे धातु के रूप में वर्गीकृत नहीं किया गया है, क्योंकि यह भंगुर है, कमजोर रूप से विद्युत प्रवाह का संचालन करता है और प्रदर्शित करता है रासायनिक गुणअधातुएँ
संरचना क्रिस्टलीय सिलिकॉनहीरे की संरचना के समान। उसके क्रिस्टल में, प्रत्येक परमाणु चार अन्य सहसंयोजक बंधों से जुड़ा होता है। इसके अलावा, सिलिकॉन परमाणुओं के बीच सहसंयोजक बंधन हीरे में कार्बन परमाणुओं के बीच की तुलना में बहुत कमजोर है। सामान्य परिस्थितियों में भी, कुछ बंधन नष्ट हो जाते हैं और मुक्त इलेक्ट्रॉन प्रकट होते हैं, जो कम विद्युत चालकता का कारण बनते हैं। गर्म और रोशन होने पर, टूटे हुए बंधनों की संख्या बढ़ जाती है, इसलिए, अधिक मुक्त इलेक्ट्रॉन दिखाई देते हैं, और विद्युत चालकता बढ़ जाती है।
क्रिस्टलीय सिलिकॉन एक अर्धचालक है। अर्धचालक ऐसे पदार्थ होते हैं जिनकी विद्युत चालकता धातुओं और ढांकता हुआ की चालकता के बीच मध्यवर्ती होती है। आप हाई स्कूल भौतिकी पाठों में इस घटना का अधिक विस्तार से अध्ययन करेंगे। यह गुण एसी रेक्टिफायर और सौर पैनलों के निर्माण में सिलिकॉन के उपयोग का आधार है जो सूर्य की तापीय ऊर्जा को विद्युत ऊर्जा में परिवर्तित करते हैं। ऐसी बैटरियां कृत्रिम पृथ्वी उपग्रहों पर स्थापित की जाती हैं और जमीन पर भी उपयोग की जाती हैं।
सिलिकॉन (अनाकार और क्रिस्टलीय) की विभिन्न संरचना भी एलोट्रोपिक संशोधनों की विभिन्न रासायनिक गतिविधि को निर्धारित करती है। सामान्य परिस्थितियों में, क्रिस्टलीय सिलिकॉन निष्क्रिय होता है, जबकि अनाकार सिलिकॉन फ्लोरीन में जलता है:

गर्म होने पर, सिलिकॉन कई गैर-धातुओं (ऑक्सीजन, क्लोरीन, नाइट्रोजन, कार्बन, सल्फर) के साथ संपर्क करता है और निकल जाता है एक बड़ी संख्या कीगरमाहट। सिलिकॉन धातुओं के साथ जुड़ता है। इन यौगिकों को सिलिसाइड्स कहा जाता है।
व्यायाम।कार्य 1. उचित प्रतिक्रिया समीकरण लिखें और रेडॉक्स प्रतिक्रियाओं में सिलिकॉन के कार्यों को इंगित करें।
कार्य 2.मैग्नीशियम, एल्यूमीनियम के साथ सिलिकॉन की रासायनिक प्रतिक्रियाओं के समीकरण लिखें। ऑक्सीकरण एजेंट, कम करने वाले एजेंट को निर्दिष्ट करें। पता लगाएँ कि सिलिकॉन किस ऑक्सीकरण अवस्था को प्रदर्शित करता है।
एसिड (हाइड्रोफ्लोरिक एचएफ को छोड़कर) सिलिकॉन पर कार्य नहीं करते हैं, हालांकि, जब क्षार धातु हाइड्रॉक्साइड सिलिकॉन के साथ जुड़े होते हैं, तो सिलिकिक एसिड का एक नमक बनता है - सिलिकेट और हाइड्रोजन:
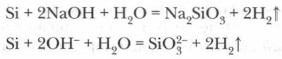
पर उच्च तापमानसिलिकॉन कई धातुओं को उनके ऑक्साइड से पुनर्स्थापित करता है:
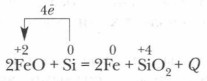
प्रकृति में सिलिकॉन अपने शुद्ध रूप में नहीं पाया जाता है।
सिलिकॉन पहली बार 1822 में स्वीडिश वैज्ञानिक आई. बर्ज़ेलियस द्वारा 400 डिग्री सेल्सियस तक गर्म करने पर पोटेशियम धातु के साथ सिलिकॉन फ्लोराइड SiF 4 को कम करके प्राप्त किया गया था। धात्विक मैग्नीशियम के साथ SiO2 को कम करके इसे प्राप्त करना और भी आसान है:
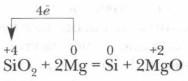
उद्योग में, सिलिकॉन आमतौर पर रेत और कोक के मिश्रण को गर्म करके प्राप्त किया जाता है:
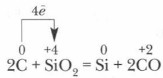
कम किया गया सिलिकॉन अतिरिक्त कार्बन के साथ आंशिक रूप से प्रतिक्रिया करके बनता है कारबरंडमकार्बोरंडम में हीरे जैसी क्रिस्टल जाली होती है, इसमें सहसंयोजक बंधन बहुत मजबूत होते हैं, इसलिए यह कठोरता में हीरे के करीब होता है, और इसका उपयोग ग्राइंडस्टोन और ग्राइंडिंग व्हील बनाने के लिए किया जाता है।
व्यायाम। SiC का सही नाम क्या है - सिलिकॉन कार्बाइड या कार्बन सिलिसाइड? तर्कपूर्ण उत्तर दीजिये.
सिलिकॉन यौगिक
प्रकृति में सिलिकॉन मुख्यतः सिलिका (रेत) SiO2 तथा सिलिकेट के रूप में पाया जाता है। सिलिकॉन ऑक्साइड (IV) के शुद्ध क्रिस्टल कई बहुरूपी संशोधन बनाते हैं, जिनमें से एक क्वार्ट्ज है, जो रॉक क्रिस्टल के रूप में होता है। सुंदर रंगीन क्वार्ट्ज क्रिस्टल (नीलम, धुएँ के रंग का पुखराज, काला मोरियन, कारेलियन, एगेट, ओपल, जैस्पर, आदि) अर्ध-कीमती पत्थर हैं।
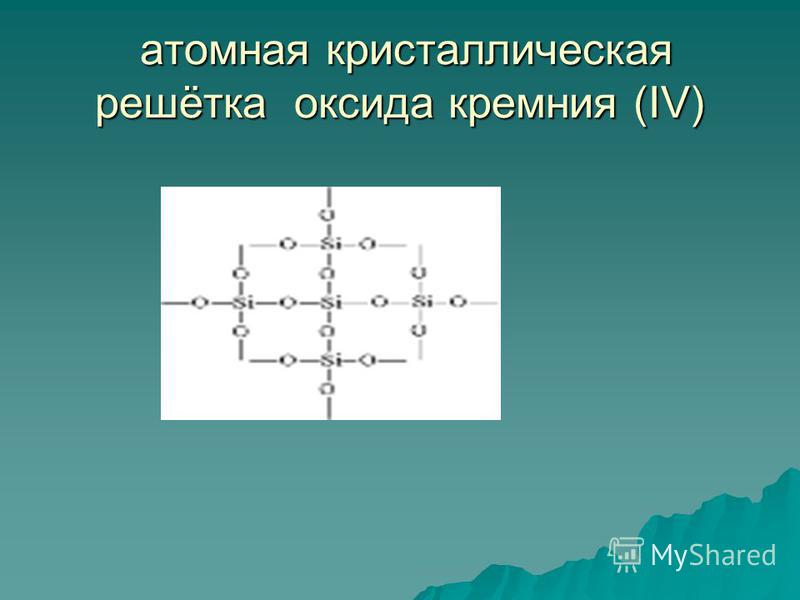
सिलिकॉन(IV) ऑक्साइड SiO2 एक ठोस दुर्दम्य पदार्थ (गलनांक 1713 डिग्री सेल्सियस) है, पानी में अघुलनशील (चित्र 54)। उसका स्वामित्व परमाणुक्रिस्टल जाली (चित्र 55): यहां कोई अणु नहीं हैं, प्रत्येक सिलिकॉन परमाणु के पास चार ऑक्सीजन परमाणु स्थित हैं - एक प्रकार का स्थानिक ढाँचा. क्वार्ट्ज का एक टुकड़ा एक विशाल अणु की तरह है। क्वार्टज़ एक अकार्बनिक बहुलक है, इसका सूत्र (SiO2) n है।
पीएससीई की विशेषताएं 1. पीएससीई में स्थिति। 1. पीएससीई में पद. 4 समूह, मुख्य उपसमूह, 4 समूह, मुख्य उपसमूह, 3 अवधि। 3 पंक्ति 3 अवधि। 3 पंक्ति Ar=28 Ar=28 ऑक्सीकरण अवस्था: ऑक्सीकरण अवस्था: -4, ऑक्साइड: ऑक्साइड: SiO (उदासीन) SiO (उदासीन) SiO 2 (अम्लीय) SiO 2 (अम्लीय) सिलिकिक अम्ल सिलिकिक अम्ल H 2 SiO 3 H 2 SiO 3
Z=+14 Z= p=14 +1 p=14 0 n=28-14=14 0 n=28-14=14 e=14 e=14 +14) 2) 8) 4 +14) 2) 8 ) एस 2एस 2पी 3एस 3पी

सिलिकॉन तीसरा (ऑक्सीजन और हाइड्रोजन के बाद) है सिलिकॉन तीसरा (ऑक्सीजन और हाइड्रोजन के बाद) सबसे प्रचुर तत्व है: यह तत्व की प्रचुरता के लिए जिम्मेदार है: यह पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 16.7% है। पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 16.7%। प्रकृति में, सिलिकॉन केवल डाइऑक्साइड और सिलिकिक एसिड (सिलिकेट्स) के लवण के रूप में होता है। एलुमिनोसिलिकेट्स सबसे व्यापक हैं। प्रकृति में, सिलिकॉन केवल डाइऑक्साइड और सिलिकिक एसिड (सिलिकेट्स) के लवण के रूप में होता है। एलुमिनोसिलिकेट्स सबसे व्यापक हैं।

बुनियादी सिलिकॉन खनिज बुनियादी सिलिकॉन खनिज Al 2 O 3 *2SiO 2 *2H 2 O – सफेद चिकनी मिट्टी Al 2 O 3 * 2SiO 2 * 2H 2 O - सफेद मिट्टी K 2 O * Al 2 O 3 * SiO 2 - फेल्डस्पार K 2 O * Al 2 O 3 * SiO 2 - फेल्डस्पार K 2 O * Al 2 O 3 * 6SiO 2 * एच 2 ओ - अभ्रक के 2 ओ * अल 2 ओ 3 * 6SiO 2 * एच 2 ओ - अभ्रक SiO 2 - सिलिका या नदी की रेत SiO 2 - सिलिका या नदी की रेत

खनिजों और चट्टानों के साम्राज्य में सिलिकॉन मुख्य तत्व है। अधिकतर यह क्वार्ट्ज खनिजों (जिनकी किस्में फ्लिंट, सिलिका (रेत), एगेट, जैस्पर) और रॉक क्रिस्टल (जिनकी किस्में हैं: एमेथिस्ट, स्मोकी पुखराज) के रूप में पाई जाती हैं। खनिजों और चट्टानों के साम्राज्य में सिलिकॉन मुख्य तत्व है। अधिकतर यह क्वार्ट्ज खनिजों (जिनकी किस्में फ्लिंट, सिलिका (रेत), एगेट, जैस्पर) और रॉक क्रिस्टल (जिनकी किस्में हैं: एमेथिस्ट, स्मोकी पुखराज) के रूप में पाई जाती हैं। सिलिकॉन लगभग कभी भी मुक्त रूप में नहीं पाया जाता है। सिलिकॉन लगभग कभी भी मुक्त रूप में नहीं पाया जाता है।

कुछ समुद्री जीव बड़ी मात्रा में सिलिकॉन जमा कर लेते हैं। कुछ समुद्री जीव बड़ी मात्रा में सिलिकॉन जमा कर लेते हैं। इनमें समृद्ध समुद्री पौधों में डायटम शामिल हैं, और जानवरों से, रेडिओलेरियन और सिलिकॉन स्पंज में बहुत अधिक सिलिकॉन होता है। इनमें समृद्ध समुद्री पौधों में डायटम शामिल हैं, और जानवरों से, रेडिओलेरियन और सिलिकॉन स्पंज में बहुत अधिक सिलिकॉन होता है।

ए. उद्योग में - बिजली भट्टियों में कोयले के साथ वसूली ए. उद्योग में - विद्युत भट्टियों में कोयले की कमी SiO 2 +2C=Si+2CO SiO 2 +2C=Si+2CO b. प्रयोगशाला में - सिलिका की धातु कमी बी। प्रयोगशाला में - सिलिका धातुओं की कमी 3SiO 2 + 4Al = 3Si + 2Al 2 O 3 3SiO 2 + 4Al = 3Si + 2Al 2 O 3

1) अनाकार सिलिकॉन - भूरा पाउडर 1) अनाकार सिलिकॉन - भूरा पाउडर पिघलने वाला टी 1420 सी। पिघलने वाला टी 1420 सी। 2) क्रिस्टलीय सिलिकॉन - एक ठोस, हल्की धात्विक चमक के साथ गहरे भूरे रंग का, जिसमें गर्मी और विद्युत चालकता होती है 2) क्रिस्टलीय सिलिकॉन - ठोस, हल्की धात्विक चमक वाला गहरा भूरा, इसमें तापीय और विद्युत चालकता होती है

ए) के साथ बातचीत सरल पदार्थ. ए) सरल पदार्थों के साथ बातचीत। Si कम करने वाला एजेंट Si कम करने वाला एजेंट 1) हैलोजन के साथ 1) हैलोजन के साथ Si+2F 2 =SF 4 - सिलिकॉन फ्लोराइड Si+2F 2 =SF 4 - सिलिकॉन फ्लोराइड 2) ऑक्सीजन के साथ 2) ऑक्सीजन के साथ Si+O 2 SiO 2 ऑक्साइड सिलिकॉन (lV) Si + O 2 SiO 2 - सिलिकॉन ऑक्साइड (lV) 3) नाइट्रोजन के साथ 3) नाइट्रोजन के साथ 3Si + 2N 2 = Si 3 N 4 - सिलिकॉन नाइट्राइड 3Si + 2N 2 = Si 3 N 4 - सिलिकॉन नाइट्राइड 4) के साथ कार्बन 4) कार्बन के साथ Si + C= SiC - सिलिकॉन कार्बाइड या Si + C= SiC - सिलिकॉन कार्बाइड या कार्बोरंडम कार्बोरंडम

सी-ऑक्सीडाइज़र सी-ऑक्सीडाइज़र 5) धातुओं के साथ 5) धातुओं के साथ सी + 2एमजी = टी एमजी 2 सी - मैग्नीशियम सिलिसाइड सी + 2एमजी = टी एमजी 2 सी - मैग्नीशियम सिलिसाइड सिलिकॉन सीधे हाइड्रोजन के साथ प्रतिक्रिया नहीं करता है। सिलिकॉन हाइड्रोजन के साथ सीधे प्रतिक्रिया नहीं करता है। SiH 4 अप्रत्यक्ष रूप से प्राप्त होता है। SiH 4 अप्रत्यक्ष रूप से प्राप्त होता है। Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (सिलेन, जहरीली गैस) (सिलेन, जहरीली गैस)

बी) जटिल पदार्थों के साथ परस्पर क्रिया 1) हाइड्रोजन हैलाइड से, प्रतिक्रिया केवल एचएफ के साथ आगे बढ़ती है 1) हाइड्रोजन हैलाइड से, प्रतिक्रिया केवल एचएफ सी + 4एचएफ = सीआईएफ 4 + 2एच 2 सी + 4एचएफ = सीआईएफ 4 + 2एच 2 2 के साथ आगे बढ़ती है। एसिड से, प्रतिक्रिया केवल नाइट्रिक और हाइड्रोफ्लोरिक 2 के मिश्रण के साथ आगे बढ़ती है) एसिड से, प्रतिक्रिया केवल नाइट्रिक और हाइड्रोफ्लोरिक 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + के मिश्रण से आगे बढ़ती है। 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O अन्य एसिड की कार्रवाई के तहत सिलिकॉन की सतह पर SiO 2 की एक घनी ऑक्साइड फिल्म बनती है। अन्य एसिड की कार्रवाई के तहत, SiO 2 की एक घनी ऑक्साइड फिल्म सिलिकॉन की सतह पर बनती है। सिलिकॉन की सतह 3) क्षार के साथ परस्पर क्रिया 3) क्षार के साथ परस्पर क्रिया + H 2 O = Na 2 SiO 3 + 2H 2

खुलना. 1834 में रूसी रसायनज्ञ हेस ने इस तत्व को रूसी नाम दिया। 1834 में रूसी रसायनज्ञ हेस ने इस तत्व को रूसी नाम दिया। सिलिकॉन की खोज 1825 में हुई सिलिकॉन की खोज 1825 में स्वीडिश रसायनज्ञ बर्ज़ेलियस ने की थी। बर्ज़ेलियस.

अनुप्रयोग इसका उपयोग इंजीनियरिंग में अर्धचालक सामग्री और मिश्र धातुओं के उत्पादन के लिए किया जाता है। इसके अलावा कांच और सीमेंट के उत्पादन के लिए, धातु काटने वाली मशीनों के लिए कटर का भी उपयोग किया जाता है। इसका उपयोग इंजीनियरिंग में अर्धचालक सामग्री और मिश्र धातु प्राप्त करने के लिए किया जाता है। इसके अलावा कांच और सीमेंट के उत्पादन के लिए, धातु काटने वाली मशीनों के लिए कटर का भी उपयोग किया जाता है।

सिलिकॉन (IV) ऑक्साइड या सिलिका सिलिकॉन (IV) ऑक्साइड या सिलिका 1. संरचना: सिलिकॉन (IV) ऑक्साइड में एक आणविक (कार्बन डाइऑक्साइड की तरह) नहीं है, बल्कि एक परमाणु क्रिस्टल जाली है 1. संरचना: सिलिकॉन (IV) ऑक्साइड में एक गैर है -आणविक (कार्बन डाइऑक्साइड की तरह), लेकिन परमाणु क्रिस्टल जाली इसलिए, SiO 2 एक ठोस और दुर्दम्य पदार्थ है, इसलिए, SiO 2 एक ठोस और दुर्दम्य पदार्थ है, जो हाइड्रोफ्लोरिक को छोड़कर पानी और एसिड में नहीं घुलता है (हाइड्रोहेलिक एसिड याद रखें) ). जो हाइड्रोफ्लोरिक (हाइड्रोहेलिक एसिड याद रखें) को छोड़कर पानी और एसिड में अघुलनशील है।