Silīcija pozīcija ķīmisko elementu periodiskajā tabulā
Sērijas numurs - 14, kodollādiņš +14, protoni kodolā - 14, elektroni - 14. Perioda numurs III - 14 elektroni pārvietojas pa trim enerģijas līmeņiem. Grupas numurs IV - ārējā enerģijas līmenī ir 4 elektroni. Atoma rādiuss ir lielāks nekā oglekļa rādiuss - palielinās spēja atgriezt elektronus. Paaugstinātas metāliskās un reducējošās īpašības (salīdzinājumā ar oglekli). Si Ge Sn Pb. vispārīgās īpašības silīcijs pēc pozīcijas periodiskajā sistēmā. C.
2. bilde no prezentācijas "Silīcijs" uz ķīmijas stundām par tēmu "Silīcijs"Izmēri: 960 x 720 pikseļi, formāts: jpg. Lai bez maksas lejupielādētu attēlu ķīmijas stundai, ar peles labo pogu noklikšķiniet uz attēla un noklikšķiniet uz "Saglabāt attēlu kā...". Lai nodarbībā parādītu bildes, bez maksas var lejupielādēt arī pilnu prezentāciju "Silicon.ppt" ar visām bildēm zip arhīvā. Arhīva izmērs - 562 KB.
Lejupielādēt prezentācijuSilīcijs
"Silīcija nodarbība" - Oglekļa dioksīds par sevi un cilvēci. Darbs pāros, savstarpēja pārbaude - nav kļūdu (5), divas kļūdas (4) utt. 3% gaisā - reibonis, troksnis ausīs, miegainība. 20% ir nāvējoši cilvēkiem. Par nemetālisko un metālisko īpašību izpausmi. Komandas vērtējums. Ko var teikt par atomu rādiusu lielumu no oglekļa līdz svinam?
"Silīcijs un tā savienojumi" - Apsveriet dabiskos silīcija savienojumus. Aprakstiet elementu silīcijs. Silīcija iegūšana. Pirmo reizi silīciju 1811. gadā atklāja Gay-Lussac un Tenard. Atomu uzbūve un īpašības. Silīcija oksīds atšķirībā no oglekļa monoksīda (IV) nesadarbojas ar ūdeni. Pusvadītājs. kušanas temperatūra (Si) = 1415 ° C, kušanas temperatūra (dimants) = 3730 ° C.
"Silīcija izotopi" — polikristāliskā silīcija iegūšana. Ramana joslas maksimuma pozīcijas atkarība no atomu masas. Deglis. Viena kristāla sēklu ražošana. Zonu attīrīts silīcijs. Aizsargpārklājums. Izotopiski bagātināta silīcija-28 siltumvadītspēja. Vienkristālu audzēšana. Izotopu koncentrācijas sadalījums sēklu garumā.
"Silīcija savienojumi" - kvarca šķirnes. Džaspers. Silikātu iegūšana. dabiskie silikāti. silīcija oksīds. Minerāli uz SiO2 bāzes. SiO2 ķīmiskās īpašības. Silīcija atklāšana. Silīcijs un tā savienojumi. Silīcijs. Ahāts. Oksidācijas pakāpe. Elektroniskā konfigurācija. silikāti un ūdeņradis. Rhinestone. Meklēšana dabā. Silāns.
"Ogleklis un silīcijs" - Ķīmiskās īpašības. Viens no mīkstākajiem cieto vielu vidū. silikāta ķieģeļi. Šo maisījumu sauc par ražotājgāzi. 1. att. Dimanta režģa modelis. Iegūtā gāze sastāv no brīvā slāpekļa un oglekļa monoksīda (II). Vairāk nekā 99% oglekļa atmosfērā ir oglekļa dioksīda veidā. Amats PSHE.
"Silīcijs" - Pirms ārējā līmeņa pabeigšanas silīcijam trūkst 4 elektronu. Silīcija (IV) oksīds. Silīcija vispārīgie raksturojumi pēc pozīcijas periodiskajā sistēmā. Laboratorijās silīciju iegūst, reducējot silīcija oksīdu SiO2. fizikālās īpašības. Silikāti ir silīcijskābes sāļi. silikātu rūpniecība.
Kopumā tēmā ir 6 prezentācijas
Šeit jūs varat lejupielādēt nodarbību par tēmu: "Oglekļa un silīcija stāvoklis periodiskajā sistēmā ķīmiskie elementi, to atomu uzbūve. Oglekļa, allotropās modifikācijas" priekšmetam: Ķīmija. Šis dokuments palīdzēs sagatavot labu un kvalitatīvu materiālu nodarbībai.
Datums _____________ Nodarbība _______________
Temats: Oglekļa un silīcija stāvoklis ķīmisko elementu periodiskajā sistēmā, to atomu uzbūve. Oglekļa, allotropās modifikācijas.
| Atoma struktūras diagramma | Pēdējā enerģijas līmeņa elektroniskā struktūra | Izcila oksīda formulaRO 2 | Gaistošā ūdeņraža savienojuma formula RH 4 | |
| 1. Ogleklis | C+6) 2 ) 4 | …2 s 2 2 lpp 2 | C +4 O 2 | C -4 H 4 |
| 2. Silīcijs | Si +14) 2 ) 8 ) 4 | …3 s 2 3 lpp 2 | Si +4 O 2 | Si -4 H 4 |
Kā redzams no atomu uzbūves diagrammām, šo elementu ārējā enerģijas līmenī ir 4 elektroni, tāpēc ogleklim un silīcijam oksidācijas pakāpe ir +4 un -4.
No diagrammas var redzēt, ka oglekļa tilpumā ir divi nepāra elektroni ārējā līmenī (līdzīgi silīcijs). Tas izskaidro, ka oglekļa un silīcija oksidācijas pakāpe var būt +2 (piemēram, CO ir oglekļa monoksīds). Pārejot uzbudinātā stāvoklī, viens no s-elektroniem var nonākt brīvā p-orbitālē. Tad atomos parādās 4 nepāra elektroni un oksidācijas pakāpe ir +4 un -4.
2. Mainiet rekvizītus apakšgrupā
Oglekļa apakšgrupā, palielinoties sērijas numuram, palielinās atomu kodola lādiņš, elektronu skaits ārējā līmenī ir nemainīgs, enerģijas līmeņu skaits atomos palielinās un atoma rādiuss palielinās no oglekļa līdz svinam, vājinās negatīvo elektronu pievilkšanās pozitīvajam kodolam un palielinās spēja ziedot elektronus, un līdz ar to oglekļa apakšgrupā, palielinoties sērijas numuram, samazinās nemetāliskās īpašības un palielinās metāliskās īpašības.
C un Si ir nemetāli, Ge ir pusvadītājs, Sn un Pb ir metāli.
OGLEKLIS. OGLEKĻA ALOTRPOPIJA
Ogleklis ir atrodams dabā, gan brīvā formā, gan savienojumos. Tas notiek brīvā formā kā allotropās modifikācijas– dimants, grafīts, karabīns, fullerēns.
Dimants
Kristāliska viela, caurspīdīga, spēcīgi lauž gaismas starus, ļoti cieta, nevada elektrisko strāvu, slikti vada siltumu, ρ = 3,5 g/cm3; t°pl. = 3730°C; t° vārīšanās = 4830°C.
Var iegūt no grafīta pie p > 50 tūkst atm; t° = 1200°C.
Pielietojums:
Slīpēšanas pulveris, urbji, stikla griezēji, pēc griešanas - dimanti.
Grafīts
Kristāliska viela, slāņaina, necaurspīdīga, tumši pelēka, ar metālisku spīdumu, mīksta, vada elektrisko strāvu; ρ \u003d 2,5 g / cm 3.
Pielietojums:
Elektrodi, zīmuļu vadi, neitronu moderators kodolreaktoros ir daļa no dažām smērvielām.
Karabīne
Melns pulveris; ρ \u003d 2 g / cm 3; pusvadītājs.
Sastāv no lineārām ķēdēm –C≡C–C≡C– un =C=C=C=C=.
Sildot, tas pārvēršas grafītā.
NodarbībaSilīcijs ir vissvarīgākais zemes garozas elements, izplatības ziņā tas ieņem otro vietu aiz skābekļa (apmēram 27,6%).
Silīcijam ir trīs izotopi: i (92,27%); (4,68%); (3,05%).
Silīcijs pastāv divās allotropās modifikācijās: amorfs Un kristāls. Struktūras atšķirība nosaka arī atšķirību fizikālās īpašībasšīs modifikācijas. Amorfs silīcijs- brūns pulveris, tam nav noteikta kušanas punkta. Kristālisks silīcijs ar izskats līdzīgs metālam, tumši pelēks ar metālisku spīdumu, ugunsizturīgs (kušanas temperatūra 1400 °C), taču tas nav klasificēts kā metāls, jo ir trausls, vāji vada elektrisko strāvu un uzrāda Ķīmiskās īpašības nemetāli.
Struktūra kristāliskais silīcijs līdzīga dimanta struktūrai. Viņa kristālā katrs atoms ir saistīts ar četrām citām kovalentām saitēm. Turklāt kovalentā saite starp silīcija atomiem ir daudz vājāka nekā starp oglekļa atomiem dimantā. Pat normālos apstākļos dažas saites tiek iznīcinātas un parādās brīvie elektroni, kas izraisa nelielu elektrovadītspēju. Sildot un apgaismojot, palielinās sarauto saišu skaits, tāpēc parādās vairāk brīvo elektronu un palielinās elektriskā vadītspēja.
Kristāliskais silīcijs ir pusvadītājs. Pusvadītāji ir vielas, kuru elektrovadītspēja ir starpposma starp metālu un dielektriķu vadītspēju. Šo fenomenu sīkāk pētīsiet vidusskolas fizikas stundās. Šis īpašums ir pamats silīcija izmantošanai maiņstrāvas taisngriežu un saules paneļu ražošanā, kas pārvērš saules siltumenerģiju elektroenerģijā. Šādas baterijas tiek uzstādītas mākslīgajos Zemes pavadoņos un tiek izmantotas arī uz zemes.
Atšķirīgā silīcija struktūra (amorfā un kristāliskā) nosaka arī alotropo modifikāciju atšķirīgo ķīmisko aktivitāti. Normālos apstākļos kristāliskais silīcijs ir inerts, bet amorfais silīcijs deg fluorā:

Karsējot, silīcijs mijiedarbojas ar daudziem nemetāliem (skābekli, hloru, slāpekli, oglekli, sēru) un izdalās liels skaits siltumu. Silīcijs savienojas ar metāliem. Šos savienojumus sauc par silicīdiem.
Vingrinājums. Uzdevums 1. Uzrakstiet atbilstošos reakciju vienādojumus un norādiet silīcija funkcijas redoksreakcijās.
2. uzdevums. Uzrakstiet silīcija ķīmisko reakciju vienādojumus ar magniju, alumīniju. Norādiet oksidētāju, reducētāju. Uzziniet, kāds ir silīcija oksidācijas stāvoklis.
Skābes (izņemot fluorūdeņražu HF) uz silīciju neiedarbojas, taču, sakausējot sārmu metālu hidroksīdus ar silīciju, veidojas silīcijskābes sāls - silikāts un ūdeņradis:
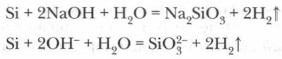
Plkst paaugstināta temperatūra Silīcijs atjauno daudzus metālus no to oksīdiem:
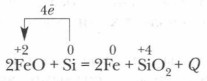
Silīcijs dabā nav atrodams tīrā veidā.
Pirmo reizi silīciju 1822. gadā ieguva zviedru zinātnieks I. Berzēliuss, silīcija fluorīdu SiF 4 reducējot ar metālu kāliju, uzkarsējot līdz 400 °C. Vēl vieglāk to iegūt, reducējot SiO 2 ar metālisku magniju:
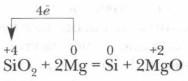
Rūpniecībā silīciju parasti iegūst, karsējot smilšu un koksa maisījumu:
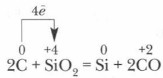
Reducētais silīcijs daļēji reaģē ar lieko oglekli, veidojot karborunds Karborundam ir dimantiem līdzīgs kristāla režģis, tajā esošās kovalentās saites ir ļoti spēcīgas, tāpēc pēc cietības tas ir tuvu dimantam, un to izmanto slīpakmeņu un slīpripu izgatavošanai.
Vingrinājums. Kāds ir pareizais SiC nosaukums – silīcija karbīds vai oglekļa silicīds? Sniedziet argumentētu atbildi.
Silīcija savienojumi
Dabā silīcijs galvenokārt atrodams silīcija dioksīda (smilšu) SiO 2 un silikātu veidā. Tīri silīcija oksīda (IV) kristāli veido vairākas polimorfas modifikācijas, no kurām viena ir kvarcs, kas sastopams kalnu kristāla formā. Skaistas krāsas kvarca kristāli (ametists, dūmu topāzs, melnais morions, karneols, ahāts, opāls, jašma u.c.) ir pusdārgakmeņi.
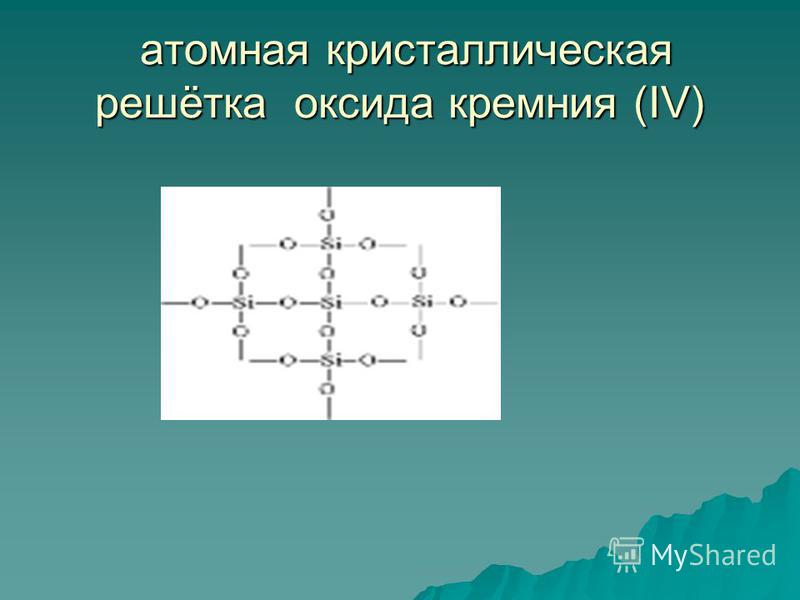
Silīcija (IV) oksīds SiO 2 ir cieta ugunsizturīga viela (kušanas temperatūra 1713 ° C), nešķīst ūdenī (54. att.). Viņam pieder atomu kristāla režģis (55. att.): šeit nav nevienas molekulas, pie katra silīcija atoma atrodas četri skābekļa atomi - sava veida telpiskais ietvars. Kvarca gabals ir kā viena milzu molekula. Kvarcs ir neorganisks polimērs, tā formula ir (SiO 2) n.
PSCE raksturojums 1. Amats PSCE. 1. Amats PSCE. 4 grupa, galvenā apakšgrupa, 4 grupa, galvenā apakšgrupa, 3 periods. 3 rindas 3 periods. 3 rinda Ar=28 Ar=28 oksidācijas pakāpe: oksidācijas pakāpe: -4, oksīdi: oksīdi: SiO (vienaldzīgs) SiO (vienaldzīgs) SiO 2 (skābā) SiO 2 (skābā) Silīcijskābe Silīcijskābe H 2 SiO 3 H 2 SiO 3
Z=+14 Z= p=14 +1 p=14 0 n=28-14=14 0 n=28-14=14 e=14 e=14 +14) 2) 8) 4 +14) 2) 8 ) S 2S 2P 3S 3P

Silīcijs ir trešais (pēc skābekļa un ūdeņraža), jo Silīcijs ir trešais (pēc skābekļa un ūdeņraža) visbiežāk sastopamais elements: tas veido elementa pārpilnību: tas veido 16,7% no kopējā atomu skaita zemes garozā. 16,7% no kopējā atomu skaita zemes garozā. Dabā silīcijs sastopams tikai silīcija skābes dioksīdu un sāļu (silikātu) veidā. Aluminosilikāti ir visizplatītākie. Dabā silīcijs sastopams tikai silīcija skābes dioksīdu un sāļu (silikātu) veidā. Aluminosilikāti ir visizplatītākie.

Pamata silīcija minerāli Pamata silīcija minerāli Al 2 O 3 * 2SiO 2 * 2H 2 O – Baltais māls Al 2 O 3 * 2SiO 2 * 2H 2 O - baltais māls K 2 O * Al 2 O 3 * SiO 2 - laukšpats K 2 O * Al 2 O 3 * SiO 2 - laukšpats K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - vizla K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - vizla SiO 2 - silīcija dioksīds vai upes smiltis SiO 2 - silīcija dioksīds vai upes smiltis

Silīcijs ir galvenais elements minerālu un iežu valstībā. Visbiežāk tas atrodams kvarca minerālu veidā (kuru šķirnes ir krams, silīcija dioksīds (smiltis), ahāts, jašma) un kalnu kristāls (kuru šķirnes ir: ametists, dūmu topāzs). Silīcijs ir galvenais elements minerālu un iežu valstībā. Visbiežāk tas atrodams kvarca minerālu veidā (kuru šķirnes ir krams, silīcija dioksīds (smiltis), ahāts, jašma) un kalnu kristāls (kuru šķirnes ir: ametists, dūmu topāzs). Silīcijs gandrīz nekad nav atrodams brīvā formā. Silīcijs gandrīz nekad nav atrodams brīvā formā.

Daži jūras organismi uzkrāj silīciju lielos daudzumos. Daži jūras organismi uzkrāj silīciju lielos daudzumos. Ar tiem bagātie jūras augi ietver kramaļģes, un no dzīvniekiem radiolāri un silīcija sūkļi satur daudz silīcija. Ar tiem bagātie jūras augi ietver kramaļģes, un no dzīvniekiem radiolāri un silīcija sūkļi satur daudz silīcija.

A. rūpniecībā - reģenerācija ar oglēm elektriskajās krāsnīs a. rūpniecībā - reducēšana ar oglēm elektriskajās krāsnīs SiO 2 +2C=Si+2CO SiO 2 +2C=Si+2CO b. laboratorijā - silīcija dioksīda metālu reducēšana b. laboratorijā - silīcija dioksīda metālu 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 reducēšana

1) amorfs silīcijs - brūns pulveris 1) amorfs silīcijs - brūns pulveris, kas kūst t 1420 C. kūst t 1420 C. 2) kristālisks silīcijs - cieta viela, tumši pelēkā krāsā ar nelielu metālisku spīdumu, ir siltuma un elektriskā vadītspēja 2) kristālisks silīcijs - ciets, tumši pelēks ar nelielu metālisku spīdumu, ir siltuma un elektriskā vadītspēja

A) mijiedarbība ar vienkāršas vielas. a) mijiedarbība ar vienkāršām vielām. Si reducētājs Si reducētājs 1) ar halogēniem 1) ar halogēniem Si+2F 2 =SF 4 - silīcija fluorīds Si+2F 2 =SF 4 - silīcija fluorīds 2) ar skābekli 2) ar skābekli Si+O 2 SiO 2 oksīds silīcijs (lV) Si + O 2 SiO 2 - silīcija oksīds (lV) 3) ar slāpekli 3) ar slāpekli 3Si + 2N 2 = Si 3 N 4 - silīcija nitrīds 3Si + 2N 2 = Si 3 N 4 - silīcija nitrīds 4) ar ogleklis 4) ar oglekli Si + C= SiC - silīcija karbīds vai Si + C= SiC - silīcija karbīds vai karborunda karborunds

Si-oksidētājs Si-oksidētājs 5) ar metāliem 5) ar metāliem Si + 2Mg \u003d t Mg 2 Si - magnija silicīds Si + 2Mg \u003d t Mg 2 Si - magnija silicīds Silīcijs tieši nereaģē ar ūdeņradi. Silīcijs tieši nereaģē ar ūdeņradi. SiH 4 iegūst netieši. SiH 4 iegūst netieši. Mg 2 Si+4HCl=2MgCl 2 +SiH 4 Mg 2 Si+4HCl=2MgCl 2 +SiH 4 (silāns, indīgā gāze) (silāns, indīgā gāze)

B) mijiedarbība ar sarežģītām vielām 1) no ūdeņraža halogenīdiem, reakcija notiek tikai ar HF 1) no ūdeņraža halogenīdiem, reakcija notiek tikai ar HF Si + 4HF = SiF 4 + 2H 2 Si + 4HF = SiF 4 + 2H 2 2) no skābēm reakcija notiek tikai ar slāpekļa un fluorūdeņraža maisījumu 2) no skābēm, reakcija notiek tikai ar slāpekļa un fluorūdeņraža maisījumu 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O Citu skābju iedarbībā uz silīcija virsmas veidojas blīva SiO 2 oksīda kārtiņa Citu skābju ietekmē uz virsmas veidojas blīva SiO 2 oksīda kārtiņa. silīcija virsma 3) mijiedarbība ar sārmiem 3) mijiedarbība ar sārmiem + H 2 O \u003d Na 2 SiO 3 + 2H 2

Atvēršana. 1834. gadā krievu ķīmiķis Hess šim elementam deva krievisko nosaukumu. 1834. gadā krievu ķīmiķis Hess šim elementam deva krievisko nosaukumu. Silīcijs tika atklāts Silīciju 1825. gadā atklāja zviedru ķīmiķis Berzēliuss 1825. gadā. Bērzeliuss.

Pielietojums To izmanto inženierzinātnēs pusvadītāju materiālu un sakausējumu ražošanai. Arī stikla un cementa ražošanai, griezēji metāla griešanas mašīnām. To izmanto inženierzinātnēs, lai iegūtu pusvadītāju materiālus un sakausējumus. Arī stikla un cementa ražošanai, griezēji metāla griešanas mašīnām.

Silīcija (IV) oksīds vai silīcija dioksīds Silīcija (IV) oksīds vai silīcija dioksīds 1. Struktūra: Silīcija (IV) oksīdam nav molekulāra (kā oglekļa dioksīdam), bet gan atomu kristāliskais režģis 1. Struktūra: Silīcija (IV) oksīdam nav -molekulārais (piemēram, oglekļa dioksīds), bet atomu kristāliskais režģis Tāpēc SiO 2 ir cieta un ugunsizturīga viela, tāpēc SiO 2 ir cieta un ugunsizturīga viela, kas nešķīst ūdenī un skābēs, izņemot fluorūdeņražu (atcerieties halogenūdeņražskābes ). Kas nešķīst ūdenī un skābēs, izņemot fluorūdeņražu (atcerieties halogenskābes).